| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 |
- calcium availability
- β-mannan
- split feeding
- Phytase
- C.P. Group
- Beta-mannanases
- egg quality
- CTCZYME
- BacterPhage
- β-Mannanases
- Nutrition
- Diseases of Swine
- Charoen Pokphand Group
- CTCBIO
- Danish Crown
- CP Group
- 김인배박사
- Exolution
- Digestibility
- β-mannanase
- Palm kernel expeller
- LAYER
- Xylannase
- Pig
- Disease challenge
- Non-starch polysaccharide
- broiler
- bacteriophage
- Low Protein
- Gut health
- Today
- Total
CTCBIO Animal Bioscience Blog
Effect of xylanase and mannanase on digestibility and gut health of nursery pigs in vivo and in vitro 본문
Effect of xylanase and mannanase on digestibility and gut health of nursery pigs in vivo and in vitro
CTCBIO 2021. 8. 2. 16:53Supplemental effect of xylanase and mannanase on nutrient digestibility and gut health of nursery pigs studied using both in vivo and in vitro models
Animal Feed Science and Technology 245 (2018) 77–90
Utsav P. Tiwaria, Hongyu Chenb, Sung Woo Kim, Rajesh Jha

In a Nutshell
In vitro 와 in vivo, xylanase and mannanase 첨가로 옥수수 DDGS를 급여한 자돈에서 apprent ileal digestibility(AID)을 증가시키고, 단쇄 지방산 short chain fatty acid (SCFA) 생산을 변경하며 장 건강에 영향 평가

In a Nutshell ; Effect of xylanase
SCFA, acetate, propionate의 농도와 총 NSP, arabinoxylan 및 GE의 AID 농도를 증가시켰다(P<0.05).
십이지장의 융모높이(P<0.05), 공장의 음와(crypt of jejunum)의 증식속도(proliferation rate), 공장의 claudin(상피를 통한 분자의 흐름을 제어하는 단백질 군), occluding(긴밀한 접합부에 위치한 형질막 단백질군) 및 ZO-1 농도를 증가시겼으며(P<0.05), 공장 소화의 점도를 감소시켰습니다(P< 0.05).
In a Nutshell ; Effect of mannanase
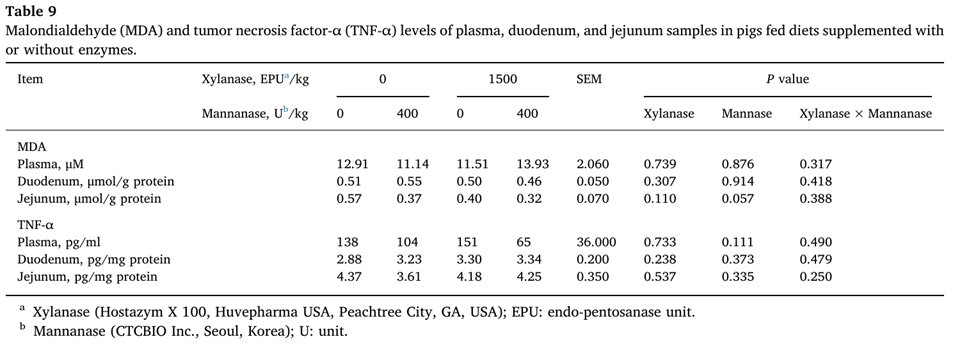
butyrate의 생산을 증가시켰고 mannan과 occludin 농도의 AID를 증가시켰으며, 공장에서 MDA 수준을 감소시키는 경향이 있었습니다(P=0.057).
Mannanase 추가는 AID 계수를 증가시켰다(P < 0.05).
Mannanase 추가로 공장에서 MDA 농도(P=0.057)를 감소시키는 경향이 있었습니다(표 9).
In a Nutshell ; Effect of xylanase and mannanase
Arabinoxylan(AX) 과 ZO-1 농도의 소화율 계수(digestibility coefficient)에 대한 상호작용 효과(P<0.05)가 발견되었다.
Xylanase and mannanase 추가사용은 표적 NSP의 소화율을 개선하고 장 건강을 개선할 수 있었다.
따라서 이러한 효소는 사료에 사용되는 성분의 유형과 다양한 섬유 부산물의 활용도를 높이고 장 건강을 개선하기 위해 자돈 사료에서 효소가 분해될 수 있는 기질(xylan or mannan)의 양에 따라 별도로 또는 함께 사용할 수 있다.
Abstract
비전분 다당류(NSP; arabinoxylan, mannans)는 distiller’s dried grain with solubles(DDGS)에 고농도로 존재한다.
이 NSP는 돼지의 내인성 소화 효소에 의해 분해되지 않는다.
이 연구의 목적은 효소의 첨가로 옥수수 DDGS를 급여한 자돈에서 apparent ileal digestibility(AID)을 증가시키고, 단쇄 지방산 short chain fatty acid (SCFA) 생산을 변경하며 장 건강에 영향을 미칠 수 있는지 확인하는 것이었다.
in vitro 와 in vivo model을 사용하여 두 가지 독립적인 연구가 수행되었다.
in vitro 실험은, xylanase(0 or 1500 endo-pentosanase unit of xylanase/kg of the diet)와 mannanase(0 or 400 unit of mannanase/kg of diet) 추가에 따라 효소적으로 분해된 잔류물을 2 × 2 factorial 배열 처리로 실험하였으며
in vivo 실험은, 15% 옥수수 DDGS를 함유한 옥수수-대두박 기반 사료에 in vitro 시험과 유사한 방식으로 32마리의 이유자돈을 사용하여 시행하였다.
종양 괴사 인자-α(tumor necrosis factor-α(TNF-α)) 및 말론디알데히드 malondialdehyde (MDA) 측정을 위해 혈장과 점막을 수집했다.
공장과 회장에서 소화 시료를 채취하여 NSP 성분을 포함한 영양소의 점도, pH 및 AID를 측정했다.
Xylanase의 추가로 SCFA, acetate, propionate의 농도와 총 NSP, arabinoxylan 및 GE의 AID 농도를 증가시켰다(P<0.05).
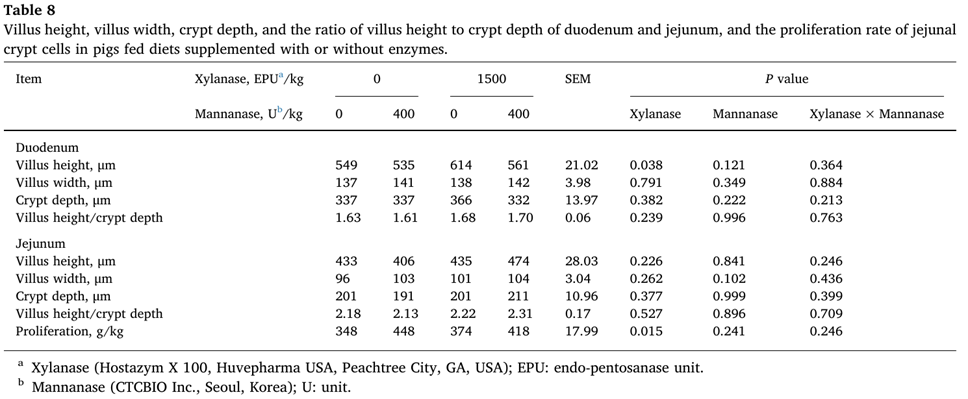
Xylanase의 추가는 십이지장의 융모높이(P<0.05), 공장의 음와(crypt of jejunum)의 증식속도 (proliferation rate), 공장의 claudin(상피를 통한 분자의 흐름을 제어하는 단백질 군), occluding(긴밀한 접합부에 위치한 형질막 단백질군) 및 ZO-1 농도를 증가시겼으며(P<0.05), 공장 소화의 점도를 감소시켰습니다(P< 0.05).
Mannanase 추가는 butyrate의 생산을 증가시켰고 mannan과 occludin 농도의 AID를 증가시켰으며, 공장에서 MDA 수준을 감소시키는 경향이 있었습니다(P=0.057).
Arabinoxylan(AX) 과 ZO-1 농도의 소화율 계수(digestibility coefficient)에 대한 xylanase and mannanase 사이의 상호작용 효과(P<0.05)가 발견되었다.
결론적으로, xylanase and mannanase 추가사용은 표적 NSP의 소화율을 개선하고 장 건강을 개선할 수 있었다.
따라서 이러한 효소는 사료에 사용되는 성분의 유형과 다양한 섬유 부산물의 활용도를 높이고 장 건강을 개선하기 위해 자돈 사료에서 효소가 분해될 수 있는 기질(xylan or mannan)의 양에 따라 별도로 또는 함께 사용할 수 있다.
Introduction
Xylanase and mannanase 보충으로 AX와 mannan을 분해하고, 공장 소화의 점도를 낮추고, 영양소의 apparent ileal digestibility(AID)을 증가시키고, 장 건강을 개선한다는 가설(개선된 장 형태, 염증 감소 또는 없음, 산화 스트레스 감소, 돼지 결장에서 증가된 단쇄 지방산(SCFA) 생산에 의해 나타난 바와 같이)을 세웠습니다.
실험1) in vitro 돼지 모델을 사용하여 DDGS의 발효 특성과 SCFA 및 BCFA 생산에 대한 효소의 영향을 결정하고
실험 2) 옥수수 DDGS가 포함된 옥수수-대두박(SBM) 기반 사료를 급여한 자돈에서 공장 소화의 점도, 영양소의 AID 및 장 건강 매개변수(융모 높이 및 음와 깊이 villus height and crypt depth, Ki-67로 표시되는 음와 세포의 증식 속도, 지질 과산화 또는 말론디알데하이드) 에 대한 xylanase, mannanase, 및 combination의 보충 효과를 결정합니다.
Materials and methods
In vitro digestion
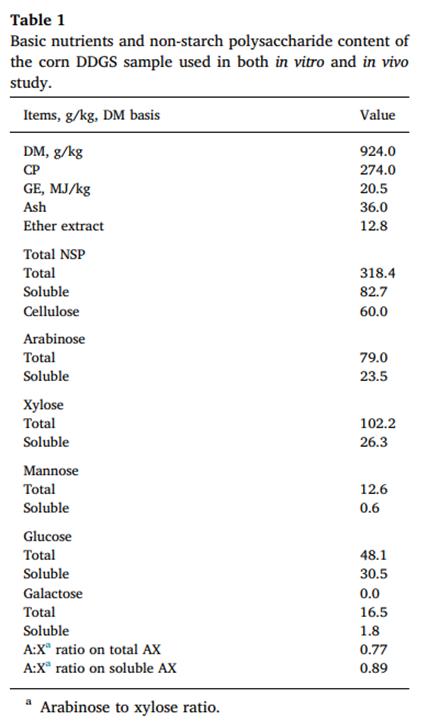
옥수수 DDGS 샘플을 분쇄하고, NSP(표1)를 포함한 영양 프로필에 대해 분석하고 2단계 시험관 내 소화(Boisen and Fernández, 1997)를 일부 수정(Jha et al., 2011)했다.
Xylanase and mannanase는 처음 2단계에서 보충하지 않고 대장 발효를 모방하면서 3단계에서 보충하였다.
인산염 완충액(100ml, 0.1M, pH 6.0)과 HCl 용액(40ml, 0.2M)을 플라스크에 부었다.
2ml의 클로람페니콜(Sigma C-0378, Sigma-Aldrich Corp., St. Louis, MO, USA) 용액(0.5g/100ml 에탄올)을 첨가하였다.
펩신 용액(4ml, 20g/l 돼지 펩신, Sigma P-0609)을 첨가하고 39℃의 수조에서 플라스크 교반(50rpm)하에 2시간 동안 두었다.
그 후, 40ml의 인산염 완충액(0.2M, pH 6.8)과 20ml의 0.6M NaOH를 용액에 첨가하였다.
판크레아틴 용액(12ml, 100g/l 판크레아틴; Sigma P-1750)을 첨가하고 동일한 조건에서 4시간 동안 가수분해를 계속하였다.
가수분해 후, 잔류물을 나일론 천(42 μm)에서 여과하여 수집하고, 에탄올(2 x 25 ml 95% 에탄올) 및 아세톤(2 x 25 ml 99.5% 아세톤)으로 세척하고, 60°C에서 12시간 건조하고 무게를 측정한다.
각 병의 소화된 잔류물은 발효를 위해 모아졌다.
가수분해된 기질의 발효량을 시험관 내에서 평가하였고, Jha et al. (2011) 에 따라 돼지에 적응된 누적 가스 생산 기술을 사용합니다.
2단계 효소 소화 후 DDGS의 잔류물은 발효 연구에서 기질로 사용되었으며, 연구는 치료의 2 × 2 요인 배열로 수행되었다.
Xylanase는 0 또는 1500 endo-pentosanase unit(EPU)의 xylanase/(옥수수 DDGS kg)로 보충되었고, mannanase는 0 또는 400 unit의 mannanase/kg 옥수수 DDGS로 보충되었다.
Xylanase(Hostazym X 100, Huvepharma USA, Peachtree City, GA, USA)는 100mg/kg의 식단으로 보충하여 1500 EPU의 xylanase/사료kg 제공했다.
하나의 EPU가 정의는
분석 조건(온도 50°C 및 pH 4.7)에서 1단위 효소 표준(1-unit enzyme standard)에서 방출된 파편(fragments)과 같은 양의 염색된 자일란(dyed xylan)에서 저분자 파편(low-molecular fragments)을 방출하는 효소의 양이다.
Mannanase(CTCZYME; CTC Bio Inc., Seoul, Korea)는 400 unit의 mannanase/kg 을 제공하기 위해 사료에 500mg/kg으로 보충되었다
mannanase 활성 1단위는 50°C 0.2M 인산나트륨(pH 6)에서 분당 mannan에서 1μmol의 mannose를 방출하는 효소의 양으로 정의됩니다.
2단계 샘플 후 수집된 200mg의 DDGS 잔류물을, 125ml 유리병에서 39°C(분당 50회 진동)에서 거대 및 미량 미네랄과 대변 접종물을 포함하는 30ml 완충 용액과 대조군 식단 및 29ml의 접종원에서 각각의 처리 그룹에서 각각의 효소 1ml 와 함께 배양했다.
분변으로부터 제조된 접종물을 20배 희석하고 250μm 스크린을 통해 여과하고 발효 기질이 있는 병으로 옮긴후, 고무 마개로 밀봉하고 인큐베이션을 위해 두었다.
접종 준비부터 배양 단계까지 CO2 가스로 플러싱하여 실험 전반에 걸쳐 혐기성 환경을 유지했습니다.
발효과정에서 생성된 가스와 SCFA의 완충에 의해 방출되는 CO2를 디지털 데이터 추적기(Tracker 211, Intertechnology Inc., Don Mills, ON, Canada) 가 장착된 압력 변환기(GP:50 SIN-54978, Grand Island, NY, USA)를 사용하여 0, 2, 5, 8, 12, 18, 24, 36, 48 및 72시간에 측정되었습니다.
발효는 72시간 인큐베이션에서 얼음물에 병을 급랭하여 중단하고, 샘플을 병에서 수집하고 나중 분석을 위해 냉동 보관했습니다.
Short chain fatty acid determination
발효 종료 후 시료를 원심분리관으로 옮기고 2500×g에서 10분간 원심분리하였다.
액체상은 Erwin et al. (1961)에서 채택하고 Jha et al. (2011)에 수정한 방법을 사용하여 SCFA 분석에 사용되었다.
0.8ml의 샘플을 0.2ml의 25% 메타인산과 0.2ml의 내부 표준 용액(트리메틸 아세트산)이 있는 튜브에 첨가하였다.
분석된 SCFA는 화염 이온화 검출기 및 Stabilwax-DA 컬럼(30 m × 0.25 mm i.d.; Rest, Bellefonte, PA, USA)이 장착된 GC시스템(TRACE™ 1300 가스 크로마토그래프, Thermo Scientific, Waltham, MA, USA)을 사용하여 acetic, propionic, butyric, isobutyric, valeric, isovaleric and caproic acids을 분석하였다.
분지쇄 지방산은 isobutyric and isovaleric acids의 합으로 계산되었다.
Animals and housing
동물 연구는 North Carolina State University(Raleigh, NC, USA)의 the metabolism educational 부서에서 수행되었다.
수유 기간 동안 creep feed가 공급되지 않은 포유자돈을 23일령에 이유하였다.
32두(PIC 337 × Camborough 22), 평균 체중이 7.5 ± 0.1 kg인 수컷 16마리와 암컷 16마리(적응 기간 6일 후)가 이 연구에 사용되었다.
시험군 돼지는 6일의 적응 기간 동안 기본 식단(표 2)을 급여하였다.
내부 온도가 26.5°C로 유지되는 환경적으로 통제된 방에 사육되었다.
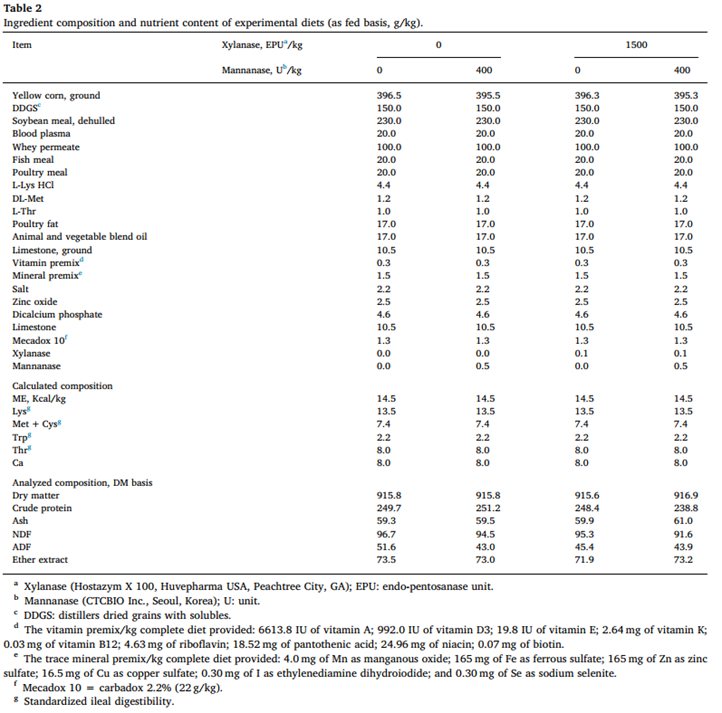
Experimental diets
옥수수, SBM, 옥수수 DDGS(사료에 150g/kg)를 주요 성분으로 사용하여 2 x 2 요인 처리 처리를 기반으로 하는 4가지 실험 식이를 공식화했다.
첫 번째 요인은 xylanase(0 or 1500 EPU of xylanase/kg of the diet)
두 번째 요인은 mannanase(0 or 400 unit of mannanase/kg of diet)
모든 사료는 돼지의 필수 영양소 요구량을 충족하도록 공식화되었다(NRC, 2012).
실험 식단의 구성은 표 2와 3에 요약되어 있다.
식이는 가루 형태로 제공되었고 20일 동안 자유롭게 먹였다.
Experimental design and sampling protocol
수유 기간 동안 creep feed를 공급하지 않았으며 23일째에 이유하였다.
시험대상군 32두를 6일의 적응 기간 동안 기본 식단을 급여하였다.
7일부터 12일까지 실험용 사료를 급여하였다(표 2).
12일째부터 이산화티타늄(titanium dioxide 0.3%)을 모든 사료에 혼합하여 돼지에게 먹였다
혈액 샘플은 18일째 혈장에 대해 BD EDTA 멸균 진공관(BD, Franklin Lakes, NJ, USA)을 사용하여 경정맥에서 수집되었다.
19일에 돼지를 밤새 금식시켰고, 20일 아침에 재급식한지 정확히 4시간 후, 돼지를 captive bolt의 관통에 의해 죽인 다음 방혈을 하였다.
안락사 후 복부를 열고 GIT를 제거했다.
회장(회장 접합부 바로 전 30cm) 및 결장(결장 내측, 30cm)의 소화 샘플을 수집하고 얼음 위에서 균질화하고 서브 샘플링했다.
점도 측정을 위해 공장에서 소화제를 수집했다.
pH 측정을 위해 공장, 회장 및 결장에서 소화제 샘플도 수집했다.
회장으로부터의 소화는 AX, 만난 및 기타 NSP를 포함한 영양소의 소화율 계수를 결정하는 데 사용되었다.
십이지장 및 중간 공장에서 조직 및 점막 샘플을 수집했다.
혈장 및 점막 샘플은 종양 괴사 인자-α(TNF-α) 및 말론디알데히드(MDA) 측정을 위한 것이었다.
조직 샘플은 조직학적 평가를 위한 것으로, 공장에서 채취한 조직도 Ki-67 단백질 염색 및 밀착연접 단백질 발현에 사용하였다.
점도 및 pH 값에 대한 소화 샘플은 안락사 직후에 측정되었다.
소화율을 위한 회장 소화 샘플은 분석할 때까지 -20 °C에서 보관되었다.
Chemical analysis
사료, 동결건조된 소화물 및 대변을 Wiley mill(Thomas Model 2 Wiley® Mill, Thomas Scientific, Swedesboro, NJ, USA)을 사용하여 추가로 분쇄하여 균일한 입자 크기를 얻기 위해 1mm 스크린을 통과시켰다.
건조 물질은 AOAC 방법 930.15(2시간 동안 135°C), 회분(AOAC 942.05), 조단백질(CP)에 따라 LECO 분석기( LECO CN-2000, Leco Corp., St. Joseph, MI), 에테르 추출물(AOAC 920.39; Soxhlet 장치 및 석유 에테르 사용), 산성 세제 섬유(AOAC 973.18) 및 중성 세제 섬유(AOAC 2002.04)는 Ankom200 Fiber Analyzer(Ankom Technology, Macedon, NY, USA)를 사용하여 측정되었다.
NDF 측정에는 열안정성 아밀라아제가 사용되었다.
총 전분 함량(AOAC 996.11)은 테스트 키트(Megazyme International, Ireland, UK)를 사용하여 결정되었다.
총 에너지는 보정 표준으로서 benzoic acid와 함께 Parr Isoperibol oxygen bomb calorimeter (Parr Bomb Calorimeter 6200, Parr Instrument Co., Moline, IL, USA)를 사용하여 결정되었다.
DM, GE, NSP, AX 및 mannan의 Apparent ileal digestibility(AID) 계수는 사료 및 회장 소화물내 titanium dioxide 농도를 사용하여 계산되었다.
소화율을 계산하기 위해 아래 방정식이 사용되었다.

- Titanium dioxide feed 가 사료내 titanium dioxide 농도이며
- Titanium dioxide digesta 는 회장 소화관에 있는 titanium dioxide 농도이며,
- Nutrientfeed 는 사료에 함유된 영양성분의 농도이며,
- Nutrient digesta 는 회장 소화의 영양소 농도이다.
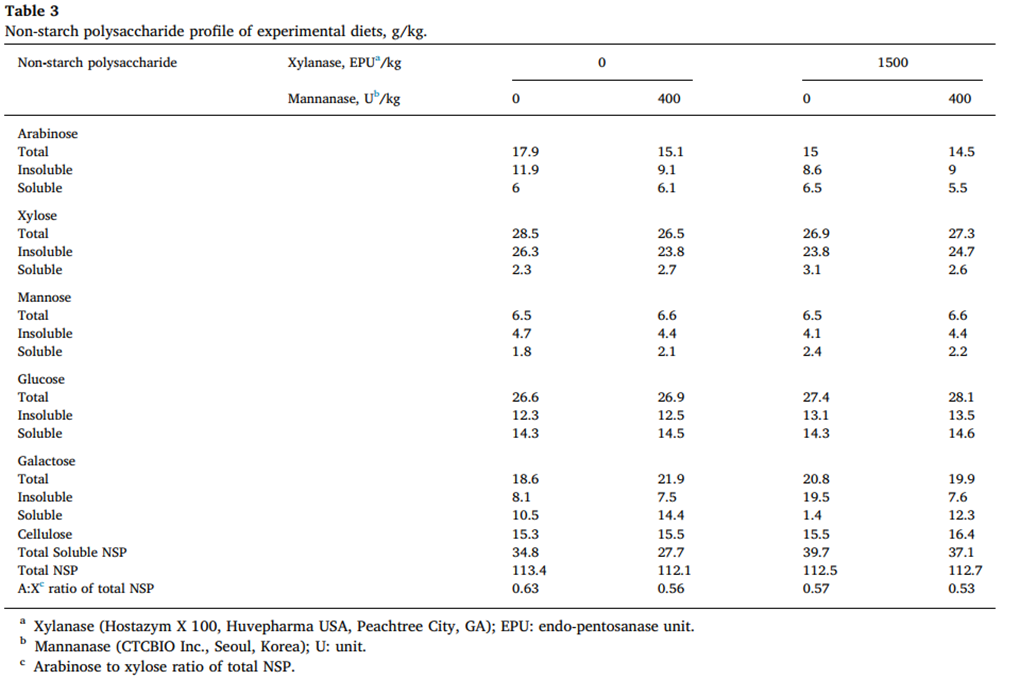
Non-starch polysaccharide determination
Englyst et al. (1994)의 방법에 따라 DDGS의 총 NSP 및 가용성 NSP와 구성 당을 포함하는 시험 사료를 가스 크로마토그래피로 정량화했다.
2-Deoxy-D-Glucose를 내부 표준물질로 사용하여 화염 이온화 검출기와 용융 실리카 모세관 컬럼 (DB-17HT, Agilent Technologies, Wilmington, DE, USA)이 장착된 GC시스템(TRACE™ 1300 gas chromatograph, Thermo Scientific, Waltham, MA, USA)을 사용하여 크로마토그래피 분석을 수행했다.
추가 NSP 관련 계산은 다음과 같이 수행되었다.
- Cellulose = NSPglucose − non-cellulosic Polysaccharide glucose
- Total NSP = rhamnose + fucose + arabinose + xylose + mannose + NCP-glucose + cellulose (where NCP glucose is non- cellulosic polysaccharide glucose)
- Soluble NSP = total NSP – insoluble NSP
- Arabinoxylan = arabinose + xylose
Titanium oxide determination
Titanium oxide 농도는 수정된 프로토콜에 따라 측정되었다(Myers et al., 2004).
분쇄 사료 및 소화 샘플을 75ml 소화 튜브에 약 0.5g 칭량했다.
폭발적인 기화를 방지하기 위해 각 소화관에 One Kjeltab(cu-3.5, FossTM, Fisher Scientific, Hampton, NH, USA)와 selenized boiling granules 을 첨가했다.
10ml의 농축된 H2SO4를 첨가한 후, 모든 소화 튜브를 즉시 와류시켰다.
그런 다음 튜브를 흄 후드 아래에서 420°C에서 2.5시간 동안 가열했다.
튜브가 식으면 30% H2O2 2ml를 각 튜브에 노란색에서 주황색이 나타날 때까지 4회 첨가한후, 탈이온수를 추가하여 부피 표시에 도달했습니다.
튜브가 실온에 도달하면 200μl의 블랭크, 표준, 풀 및 미지의 샘플이 이중으로 410nm에서 즉시 판독되는 96 well plate 피펫팅 되었습니다.
Titanium oxide 값은 표준 곡선에서 계산하여 구했습니다.
Viscosity determination
C-40 cone and plate가 장착된 점도계 (Brookfield Digital Viscometer, Model DV2TLV, Brookfield Engineering Laboratories Inc., Stoughton, MA, USA)를 사용하여 공장 소화제의 점도를 측정했다(Passos et al., 2015).
Digesta(15ml)를 튜브에 넣고 3000xg에서 5분간 원심분리한 다음 상층액 2ml를 5ml 튜브에 옮기고 12,500xg에서 5분간 원심분리하고,
마지막으로, 상등액으로부터 얻은 0.5 ml 분취액을 점도계에 사용하여 점도를 측정하였다.
점도계는 25°C로 설정되었다.
각 샘플의 점도는 전단 속도 45.0/s 및 22.5/s에서 4회 측정되었다.
최종 결과는 45.0/s 및 22.5/s 전단 속도에서 측정된 점도 사이의 평균으로 계산되었다.
pH determination
소화(회장, 공장, 결장)물의 pH는 수집 직후 디지털 pH 측정기(Accumet, Fisher Scientific, Hampton, NH, USA)를 사용하여 측정했습니다.
Morphology and immunohistochemistry for Ki-67
조직 조각을 탈수하고 파라핀에 포맷한 다음 섹션을 가로질러 5mM 두께의 슬라이드로 절단하고 폴리리신 코팅된 슬라이드에 장착했다(Shen et al., 2012).
염색은 헤마톡실린과 에오신 염료를 사용하여 수행되었다.
융모 높이, 융모 너비 및 음와 깊이는 Olympus CX31 현미경(Lumenera Corporation, Ottawa, ON, Canada)에 부착된 Infinity 2-2 디지털 CCD 카메라로 측정되었다.
융모 높이 대 지하실 깊이의 비율도 결정되었다.
10개의 잘 지향된 온전한 융모 및 관련 선와 길이가 각 슬라이드에서 측정되었다.
공장 절편을 10% 포르말린 완충액에 3주 동안 고정하고 70% 에탄올 용액으로 옮기고 즉시 Ki-67 단백질 염색을 위해 North Carolina State University Histology Lab(Raleigh, NC, USA)으로 보냈다.
온전한 음와를 자르고 Image JS 소프트웨어를 사용하여 음와에 있는 전체 세포에 대한 Ki-67 양성 세포의 비율을 계산했다(Almeida et al., 2012).
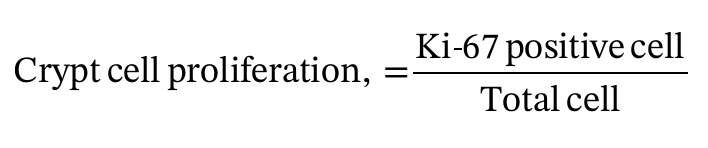
ELISA measurements for TNF-α and MDA determination
십이지장, 공장, 회장 및 결장의 점막 샘플(500mg)을 칭량하고 1.0ml PBS 용액(MP Biomedicals, LLC. Solon, OH, USA)에 현탁시켰다.
샘플을 얼음 위에서 균질화하고 균질액을 30분 동안 4°C에서 14,000 xg에서 원심분리했다.
상층액을 3개 또는 3개의 분취량 튜브로 나누어 다음 측정을 수행했다(Shen et al., 2012).
혈액 및 점막 샘플의 총 단백질은 Pierce BCA 단백질 분석 키트(#23225, Thermo Fisher Scientific Inc. Rockford, IL, USA)를 사용하여 정량화되었다.
염증 반응의 매개체로서 혈액 및 점막 샘플의 TNF-α 수준을 Porcine Immunoassay ELISA Kit(PTA00; R&D System Inc. Minneapolis, MN, USA)로 측정했다.
점막 및 혈액 샘플에서 TNF-α의 농도는 각각 pg/mg 단백질 및 pg/ml로 표시되었다.
산화 스트레스 지표로서 MDA는 Weaver 등의 지시에 따라 Thiobarbituric Acid Reactive Substance Assay Kit (STA-330, Cell Biolabs, San Diego, CA, USA)를 사용하여 분석되었다.
점막 및 혈액 샘플에서 MDA의 농도는 각각 μmol/g 단백질 및 μM으로 표시되었다.
Tight junction proteins
각 처리에서 4개의 공장 조직 샘플을 사용하여 밀착 접합 단백질을 측정했다.
간략하게, 공장의 조직 샘플(100mg)을 칭량하고 5㎕ 프로테아제 억제제 칵테일을 함유하는 0.5ml RIPA 용해 및 추출 완충액에 현탁시켰다.
조직 샘플을 얼음 위에서 균질화하였다(Tissuemiser; Thermo Fisher Scientific Inc., Rockford, IL, USA).
균질액을 4℃에서 10분 동안 10,000 xg로 원심분리하여 상청액을 수집하였다.
상층액의 단백질 농도는 위에서 언급한 바와 같이 BCA 단백질 분석을 사용하여 8 μg/μL로 조정되었다.
조정된 상층액은 수조에서 5분 동안 100°C에서 변성되었고 SDS-PAGE를 위해 각 웰에 로딩되었다.
SDS-PAGE 후, 겔을 폴리비닐리덴 디플루오라이드(PVDF) 멤브레인으로 이동시켜 표적 단백질을 멤브레인으로 전달하였다.
단백질을 1시간 동안 90mV에서 전기영동으로 옮겼다. 그런 다음 이들을 5% 탈지유에서 차단하고 claudin, occludin, zonula occludens(ZO)-1 및 β-액틴에 대한 1차 항체와 함께 배양(4°C에서 밤새)했다.
이후에 멤브레인을 세척하고 horseradish-Conjugated secondary antibodies와 함께 인큐베이션(실온에서 1시간)했다.
면역 블롯은 DAB 기질 키트(34002; Pierce, Rockford, IL, USA)로 개발되었다.
밴드의 밀도는 이미지 분석기 소프트웨어(LI-COR Biosciences, Lincoln, NE, USA)를 사용하여 확인되었다.
Results
Nutrient profile of DDGS and experimental diet
옥수수 DDGS의 단백질, 전분 및 총 에너지 함량은 각각 274g/kg, 92g/kg 및 20.5MJ/kg이었다.
옥수수 DDGS의 총 NSP 함량은 318g/kg이었고 그 중 82g/kg은 가용성 NSP였다.
AX의 총량은 181g/kg이었고 가용성 AX의 양은 49g/kg이었다.
총 AX의 arabinose 대 xylose (A:X) 비는 0.77인 반면, 가용성 AX의 A:X 비는 (0.89)이었다.
실험식이의 NSP 함량을 포함한 영양 성분은 각각 표 2와 3에 나와 있다.
모든 사료 영양소 구성은 모든 사료 식이 구성과 동일했지만 다른 용량 수준에서 보충 xylanase and mannanase 가 달랐기 때문에 유사했다.
In vitro gas production and short chain fatty acid production
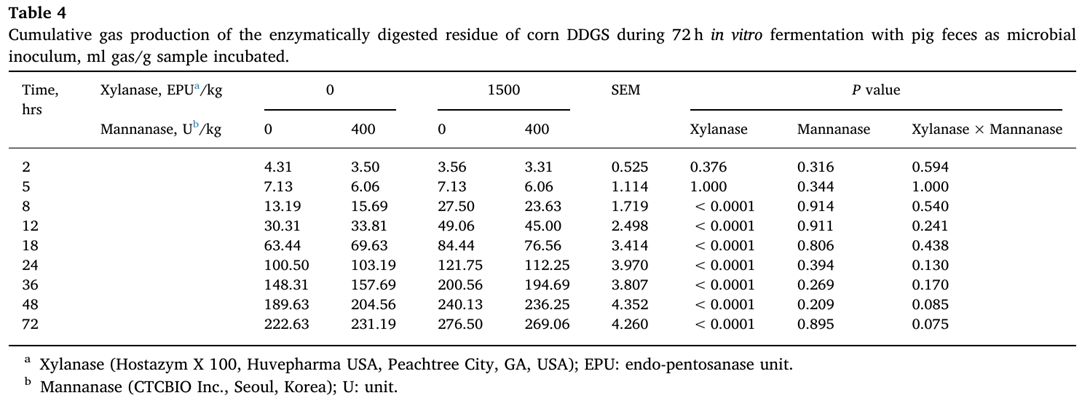
다양한 시간 간격 동안 효소적으로 소화된 옥수수 DDGS 잔류물의 누적 가스 생산은 표 4에 나와 있다.
Xylanase 보충은 8, 12, 18, 24, 36, 48 및 72시간에 가스 생산을 증가시켰다(P<0.05).
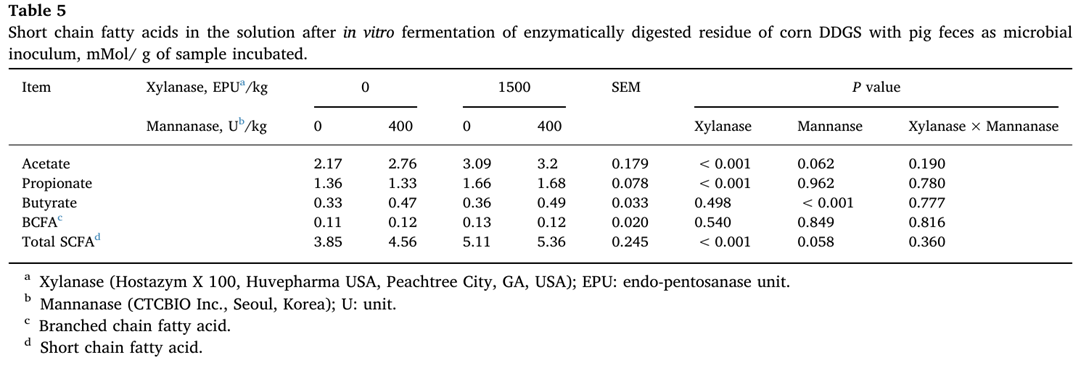
Xylanase 는 총 SCFA 뿐만 아니라 acetate, propionate 의 생산을 증가시켰다(P<0.05)(표 5).
그러나 mannanase의 효과(P<0.05)는 butyrate 생산에서만 나타났다.
BCFA 생산에 대한 효소 보충의 영향은 없었다.
Nutrient digestibility coefficient
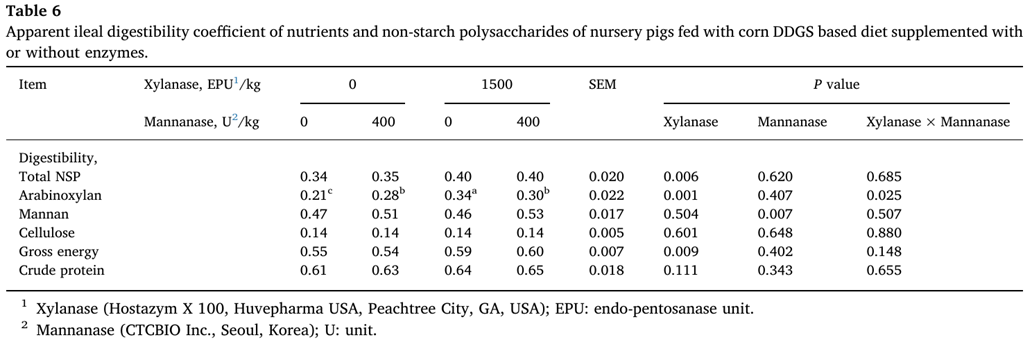
The AID coefficient of 영양소와 NSP including some individual 단량체(monomers) (AX, mannan, cellulose)는 표6에 나와 있다.
Xylanase 추가는 총 NSP와 AX의 AID 계수를 증가시켰다(P<0.05).
AX의 소화율 계수에 있어서도 xylanase and mannanase 상호작용(P<0.05)이 있었다.
Mannanase 추가는 AID 계수를 증가시켰다(P<0.05).
총 에너지의 AID 계수는 보충 xylanase 로 증가했다(P<0.05).
Physico-chemical properties of digesta
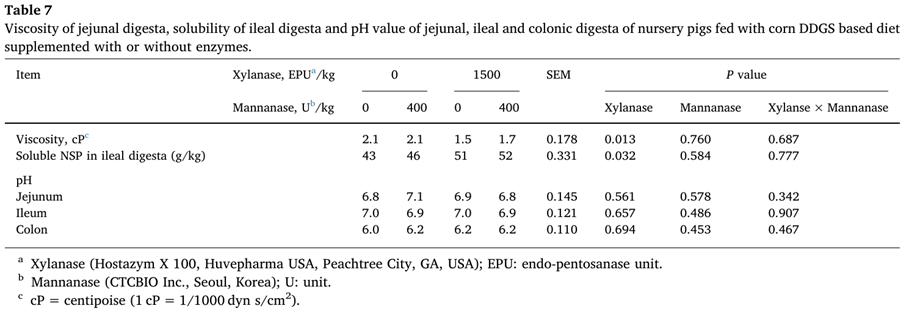
공장 소화물의 점도, 회장 소화물의 가용성 NSP의 양 및 새끼 돼지의 공장, 회장 및 결장 소화물의 pH 값이 표 7에 제시되어 있다.
Xylanase 추가로 공장 소화의 점도를 낮추었으며(P < 0.05), 회장 소화에서 가용성 NSP의 양은 증가하였다(P<0.05).
Morphology and immunohistochemistry for Ki-67
Xylanase 추가로 십이지장에서 융모 높이를 증가시켰고(P<0.05), 공장의 음와에서 증식 속도를 증가시켰다(표 8).
Immune and oxidative status
Mannanase 추가로 공장에서 MDA 농도(P=0.057)를 감소시키는 경향이 있었습니다(표 9).
Tight junction proteins
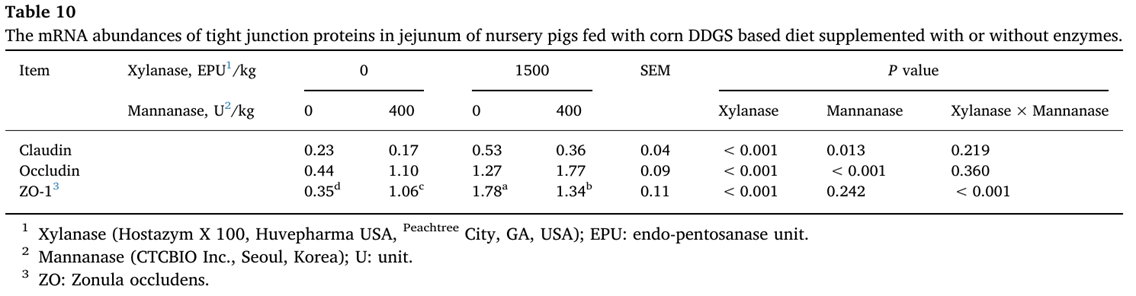
Xylanase 추가로 claudin, occludin 및 ZO-1의 농도를 증가시켰습니다(P<0.05)(표 10).
ZO-1의 농도에 있어서도 xylanase와 mannanase 사이에 상호작용(P<0.05)이 있었다.
Xylanase는 단독으로 보충되었을 때 AX의 소화율을 증가시켰습니다.
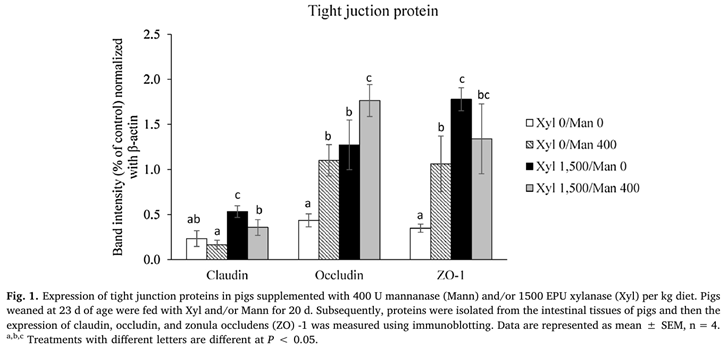
Mannanase 추가는 claudin과 occludin의 농도를 증가시켰습니다(P<0.05)(그림 1).

Discussion
이 연구는 xylanase and mannanase 추가 사용하여 AX와 mannan의 많은 부분이 shorter oligosaccharides 으로 분해되었음을 보여주며,
AX 및 mannans 과 같은 헤미셀룰로스 다당류 (hemicellulosic polysaccharide)를 분해하는 데 xylanase and mannanase 의 능력을 나타냅니다.
옥수수 DDGS에서 AX의 구조는 본 연구에서 제공된 옥수수 DDGS 기반 식단과 마찬가지로 복잡합니다.
복잡한 AX 구조의 지표는 불용성 AX 및 arabinose to xylose (A:X) 비율의 양입니다.
A:X 비율은 xylan 골격에 치환된 arabinose의 양을 나타냅니다.
본 연구에서 제공된 옥수수 DDGS와 DDGS 기반 사료의 A:X 비율은 각각 0.77과 0.60이었다.
이것은 arabinose 의 많이 양이 대체되었음을 나타냅니다.
AX의 복잡한 구조에도 불구하고 xylanase 추가는 AX의 소화 계수와 총 NSP의 소화 계수를 증가시켰습니다(표 5).
Xylanase 는 가용성 및 불용성 AX 모두에서 xylan 골격의 β-1,4-glycosidic 결합을 절단하여 결국 불용성 AX의 부분 가용화 및 가용성 AX의 더 낮은 분자량 잔기로의 추가 단편화를 유도합니다.
효소는 표적 특이적이며 표적에만 작용합니다. 즉, xylanase 는 xylans 을 분해하고 mannanase 는 mannan 을 분해합니다.
Mannanase 추가는 mannan의 소화율을 증가시켰습니다(표 5).
식이에서 mannan 양은 적었지만, mannan 은 AX보다 돼지의 몸에서 상대적으로 더 잘 활용됩니다(xylanase 0/mannanase 0 그룹에서 AX의 소화 계수는 0.21인 반면 만난의 소화 계수는 0.47이었습니다).
이 연구에서 옥수수 DDGS의 가용성 NSP의 양은 전체 NSP의 1/4이었습니다.
Xylanase 추가로 공장 소화의 점도를 0.6 cP 감소시켰다(표 6).
Xylanase 추가는 또한 회장 소화에서 가용성 NSP의 양을 증가시켰습니다(표 6).
이는 불용성 NSP 단편의 상당 부분이 xylanase 에 의해 분해되고 증가된 에너지 소화율로 반영되었음을 나타냅니다.
장 건강은 포괄적이고 복잡한 정의로, 충분한 양분을 제공하는 식이, 장 장벽을 온전하게 유지하기 위한 점막, 균형 잡힌 건강한 미세 환경을 유지하기 위한 미생물 군집의 세 가지 주요 구성 요소를 가지고 있습니다(Montagne et al., 2003).
이 연구에서 xylanase 추가로 십이지장의 융모 높이를 증가시켰습니다.
이 연구에서 xylanase는 공장에서 crypt cell의 증식 속도를 증가시켰다.
점막 세포 증식은 위장 장벽의 완전성을 유지하는 데 필수적입니다(Wong and Wright, 1999).
장내 세포 증식은 내강 영양소와 호르몬 및 성장 인자와 같은 전신 인자를 통해 조절될 수 있으며, 또한 다른 병리학적 조건의 영향을 받습니다(Wong and Wright, 1999).
형태에 영향을 주지 않으면서 장내 증가된 세포 증식은 돼지의 장 건강을 유지하는 데 도움이 됩니다.
장에서 증식 조절의 자극은 산화 스트레스와 염증 때문일 수 있습니다(Assimakopoulos et al., 2004; Reuter et al., 2010).
이 연구의 중요한 발견 중 하나는 xylanase 추가로 공장에서 ZO-1, claudin 및 occludin의 발현을 증가시키는 반면, mannanase는 occludin의 발현을 증가시켰다는 것입니다.
ZO-1의 발현에 대한 xylanase and mannanase 사이의 상호작용 효과도 있었고,
Xylanase와 mannanase는 단독으로 보충되었을 때 ZO-1의 발현을 증가시켰습니다.
In vivo study 는 xylanase 추가로 의해 분해된 AX의 양을 정량화하는 반면 시험관 내에서는 DDGS에서 xylanase 추가하여, 총 SCFA, 아세테이트 및 프로피오네이트의 생산뿐만 아니라 더 높은 누적 가스 생산으로 표시되는 DDGS의 발효과 증가된다.
인큐베이션 몇 시간 후 가스 생성의 상대적 증가(표 4)는 대장 근위 부분에 xylanase 추가로 발효가 빠르게 시작되었음을 나타냅니다.
미생물이 탄수화물을 이용할 수 있는 한 그들은 미생물을 먹습니다.
그러나 원위 결장에서 탄수화물 공급은 일반적으로 최소화되고 미생물은 단백질을 섭취하고 발효하기 시작하여 결장 질환을 유발하는 유해한 대사 산물을 생성합니다(Jha 및 Berrocoso, 2016).
Xylanase 추가로 기질의 누적 가스 생산은 배양 종료(72시간)에 더 높았으며, 이는 효소가 NSP를 분해하는 데 효과적임을 나타내며, 이는 총 SCFA 및 프로피오네이트(propionate) 생산의 증가로도 나타납니다.
프로피오네이트(propionate)는 혈류로 흡수되어 간에 도달하고 포도당 신생합성을 통해 포도당을 생성합니다.
프로피오네이트(propionate)의 더 높은 생산은 xylanase 추가로 인한 DDGS의 발효 증가로 인한 에너지 이용의 증가가 있음을 나타냅니다.
이 연구에서 mannanase 추가로 부티르산(butyrate) 생성을 증가시켰는데 이는 부티로겐butyrogenic 기질로서 만노올리고당(manno-oligosaccharide)의 역할을 나타냅니다.
부티레이트(Butyrate)는 장 건강을 유지하는 데 중요한 역할을 합니다.
부티레이트(Butyrate)는 결장 상피 세포에 에너지를 제공하고 점막 완전성을 유지하는 데 도움이 되며 세포 사멸을 감소시킵니다.
Mannanase 추가로 사용한 부티레이트(butyrate) 생성의 증가는 만노올리고당에 의한 부티로제닉 박테리아(Roseburia, Faecalibacterium, Roseburia)의 증식 또는 Prevotella 및 Bifidobacterium에 의한 발효의 결과로 생성된 아세테이트 또는 젖산의 이용 증가 때문일 수 있다(Ivarsson et al., 2014).
부티로겐 박테리아는 아세테이트 또는 젖산염을 소비하여 장에서 부티레이트를 생성합니다(Belenguer et al., 2006; Rios-Covian et al., 2015).
부티르산의 약 90%는 아세테이트에서 파생되며(Duncan et al., 2004) 아세테이트가 없으면 공급된 포도당의 75%가 젖산으로 전환됩니다.
이 연구는 NSP를 분해하는 효소의 능력과 장 건강 매개변수에 미치는 영향을 테스트하기 위해 설계되었다.
결과는 AX and mannan 이 어느 정도 분해되었음을 나타냅니다.
Xylanase의 보충은 gluconeogenesis를 통해 동물에게 에너지를 제공하는 propionate의 생산을 증가시켰다.
Mannanase의 효과는 부티레이트 생성에서 발견되었으며 결장세포에 에너지를 제공하고 장 건강을 지원하는 역할을 설명합니다.
따라서 이러한 효소는 사료에 사용되는 성분의 유형과 사용 가능한 기질(xylan or mannan)의 양에 따라 개별적으로 또는 조합하여 사용할 수 있다.
'CTCZYME > CTCZYME Swine' 카테고리의 다른 글
| Palm kernel expeller 포함 양돈사료에서 에너지 및 영양소의 회장 및 전체 소화관 소화율에 대한 phytase 와 β-mannanase 의 효과 (2) | 2021.11.23 |
|---|---|
| 저단백 양돈사료설계 참고사항 (1) | 2021.09.09 |
| Effect of reducing raw material Cost by applying CTCZYME(Swine) (0) | 2021.02.15 |
| Matrix value of CTCZYME - Swine (0) | 2021.02.15 |
| Summary of CTCZYME effects in feed - Swine (0) | 2021.02.04 |




