| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 |
- Nutrition
- Pig
- Phytase
- C.P. Group
- Danish Crown
- CTCZYME
- LAYER
- Palm kernel expeller
- Disease challenge
- β-Mannanases
- Xylannase
- 김인배박사
- Low Protein
- calcium availability
- broiler
- Exolution
- β-mannan
- CTCBIO
- β-mannanase
- Non-starch polysaccharide
- Digestibility
- Diseases of Swine
- split feeding
- Beta-mannanases
- Gut health
- bacteriophage
- CP Group
- egg quality
- Charoen Pokphand Group
- BacterPhage
- Today
- Total
CTCBIO Animal Bioscience Blog
INTRODUCTION 본문
Phytase, a New Life for an “Old” Enzyme
Xin Gen Lei,1 Jeremy D. Weaver,2 Edward Mullaney,3 Abul H. Ullah,3 and Michael J. Azain4 1
Department of Animal Science, Cornell University, Ithaca, New York 14853; email: XL20@cornell.edu
2 NIEHS-NIH, Research Triangle Park, North Carolina 27709; email: jdw25@cornell.edu
3 USDA-ARS, New Orleans, Louisiana 70124; email: edwmull@gmail.com, abul.ullah@ ars.usda.gov
4 Department of Animal Science, University of Georgia, Athens, Georgia 30602; email: mazain@uga.edu
Annu. Rev. Anim. Biosci. 2013. 1:283–309
First published online as a Review in Advance on December 13, 2012
The Annual Review of Animal Biosciences is online at animal.annualreviews.org
This article’s doi: 10.1146/annurev-animal-031412-103717
Copyright © 2013 by Annual Reviews. All rights reserved
Keywords animal, biotechnology, environment, food production, nutrition, phosphorus
Abstract
Phytases는 인산 가수분해 효소로, 인산염에서 인산염을 단계적으로 인산염에서 인산염의 이동을 시작합니다.
돼지, 가금류, 어류와 같이 위장이 단순한 동물은 식물성 사료의 주요 인 형태인 피테이트(phytate)를 소화하기 위해 체외 피타제(extrinsic phytase)가 필요합니다.
따라서 이 효소는 인의 배설을 줄이기 위해 이러한 종의 사료에 보충되며, 가장 효과적이고 수익성이 높은 사료 첨가제 중 하나로 부상했습니다.
이 장에서는 Phytases 과학과 기술의 발전 과정을 종합적으로 검토합니다.
동물 사료, 환경 보호, 암석 인 보존, 인간 영양 및 건강, 산업 응용 분야에서 Phytases의 다양한 역할에 대한 현실적인 추정치를 제공합니다.
이 책은 새로운 미생물 Phytases 및 Phytases 형질전환 식물과 동물의 개발과 관련된 새로운 생명공학 기술과 기존 이슈를 자세히 설명합니다.
또한 동물 농업, 인간 건강 및 사회적 지속 가능성을 증진하는 데 있어 파이타제의 글로벌 영향, 새로운 응용 및 향후 수요에 대한 비판적이고 통합적인 분석을 목표로 합니다.
INTRODUCTION
Overview of Phytase History
Phytase(myo-inositol hexakisphosphate phosphohydrolase)는 phytic acid (myo-inositol hexakisphosphate) 또는 salt phytate서 인산염phosphates을 단계적으로 제거하는 촉매 작용을 합니다.
특히 phytic acid에 대한 최초의 과학적 언급이 문헌에 등장한 지 불과 4년 후인 1907년(1)에 최초의 phytase가 보고되었는데(2), 이는 phytic acid에 대한 최초의 과학적 언급이 문헌에 등장한 지 불과 4년 후의 일입니다.
이 효소에 대한 연구는 100년 이상 지속되었지만, 지난 20~30년 동안 기하급수적으로 성장했습니다.
Phytase의 과학적, 실용적 중요성은 최근 Phytase 가 지난 세기 양돈 생산에서 가장 중요한 10대 발견 중 하나로 선정됨으로써 가장 잘 입증되었습니다(3).
한편, Phytase의 놀라운 영향력은 과거와 현재의 여러 리뷰에서도 인정되었습니다(4-20).
따라서 이 장에서는 이미 잘 문서화된 초기의 성과를 다시 살펴보기 위한 것이 아닙니다.
대신, 현재의 Phytase 시장을 창출한 중요한 사건과 효소의 글로벌 상용화를 위한 기술을 뒷받침한 과학적 이정표에 초점을 맞추고 있습니다.
금세기에 접어들면서 모든 Phytase가 동일한 촉매 메커니즘을 공유하는 것은 아니라는 사실이 밝혀지면서 Phytase 연구에 중요한 이정표가 되었습니다.
모든 Phytase가 phytic acid의 인산 모노에스테르 가수분해를 가능하게 하지만(21), 이러한 효소의 다양성으로 인해 이 작업을 수행하는 데 다양한 화학적 수단이 가능합니다.
가장 처음이자 가장 광범위하게 연구된 Phytase 그룹은 히스티딘산 포스파타제(HAP)(22) 계열에 속합니다.
다른 세 가지 피타제 그룹은 b-프로펠러 포스파타제(BPP; 알칼리성 피타제라고도 함)(23), 보라색 산 포스파타제(PAP; 금속 효소)(24), 단백질 티로신 포스파타제[PTP; 이중 특이성 포스파타제(DSP) 또는 시스테인 피타제라고도 함](25)로 분류됩니다.
그 후, 해당 3차원 구조와 촉매 메커니즘을 설명하기 위해 히스티딘산 파이타제(HAPhy), 비프로펠러 파이타제(BPPhy), 퍼플산 파이타제(PAPhy), 단백질 티로신 파이타제(PTPhy)라는 일반적으로 통용되는 파이타제 명명법이 제안되었습니다(7, 18)(Figure 1).
이러한 다양한 촉매 메커니즘은 피타제의 잠재적 응용 분야와 피타제가 작용할 수 있는 화학적 환경의 범위를 넓혀줍니다.
Table 1은 현재 알려진 다양한 유형의 파이타제 분포를 요약한 것입니다.
Table 1 Presently known distribution of representatives of the different catalytic classes of phytate degrading enzymes
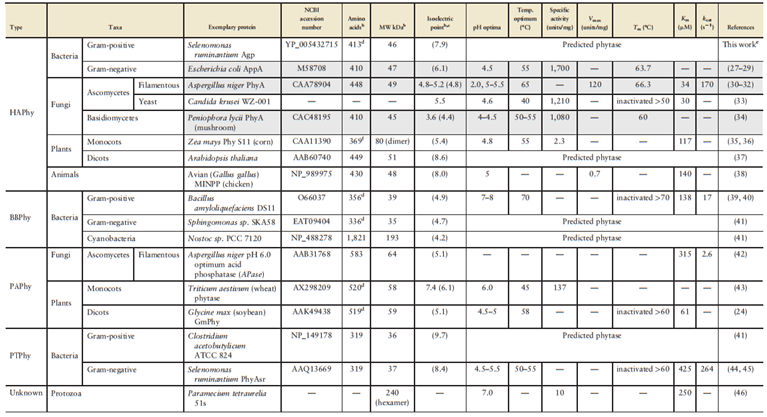
a. Only proteins confirmed to possess phytase activity or those predicted to be phytases based on sequence homology to known phytases were included. This table is not an exhaustive list and may exclude other enzymes. Highlighted proteins are commercialized (Table 2). Mention of a phytase does not constitute an endorsement by the authors or their institutes. Values represent those of the purified protein and do not reflect properties conveyed by proprietary product formulations such as coatings. Caution should be used when comparing values owing to effects of assay conditions (31). It is best to compare values from experiments done in parallel, so as to compare across the same assay conditions.
b. Mature polypeptide only.
c. Isoelectric point determined by isoelectric focusing. Value in parentheses predicted by ProtParam (47).
d. Amino acids constituting the signal peptide as predicted by SignalP (48) were removed from the NCBI entry for calculation purposes.
e Based on BLASTP searches using A. niger PhyA (CAA78904), E. coli AppA (M58708), E. coli Agp (AAA23426), and avian MINPP (NP_989975) as queries against the nonredundant sequences of gram-positive bacteria in NCBI on May 10–11, 2012. Because it most closely resembled E. coli Agp, it likely has greater activity for glucose-1-phosphate than for phytate.
f. First 18 amino acids removed according to N-terminal sequencing of the protein (35).
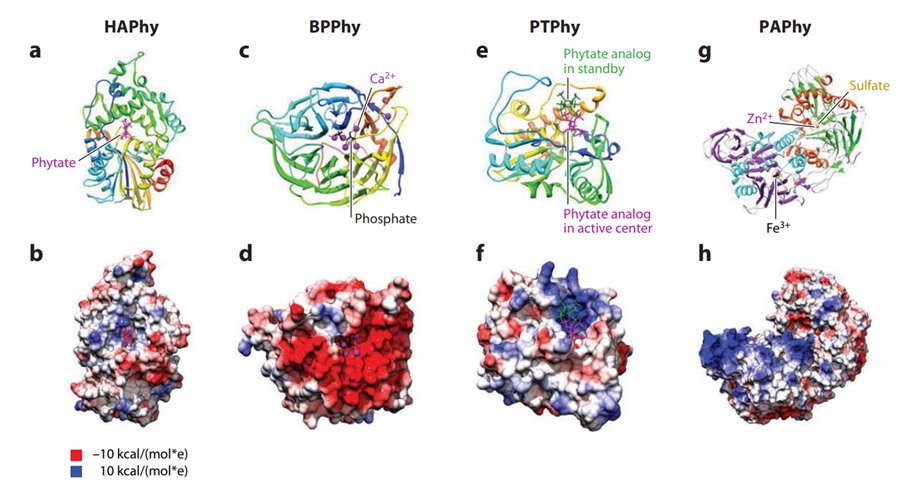
Figure 1.
Phytate analog in standby Fe 3+ Phytate analog in active center Crystal structures of representatives of each of the four structural classes of phytases. Secondary structure (first row) and surface colored by electrostatic potential (second row) are displayed. Coulombic surface coloring (Chimera) was used to calculate electrostatic potentials with charges of –10 kcal/(mol\u0002 e) (red) and 10 kcal/(mol\u0002 e) (blue) using a dielectric constant of 4.0. Images are not shown to scale. (a,b: 1DKQ) Histidine acid phytase (HAPhy), Escherichia coli AppA in complex with phytate (magenta) in the active center. (c,d: 1H6L) b-propeller phytase (BPPhy), Bacillus amyloliquefaciens phytase in complex with Ca2þ (magenta) and phosphate (black). Four Ca2þ ions are involved in catalysis and creation of a favorable electrostatic potential; three stabilize the enzyme. (e,f: 1U25, 1U26) Protein tyrosine phytase (PTPhy), Selenomonas ruminantium phytase in complex with myo-inositol hexasulfate (phytate analog) in the standby position (green) and in the active center (magenta). The inositol hexasulfate has five axial and one equitorial sulfates, in contrast to the more general five equitorial and one axial phosphates of phytate seen in crystal structures of HAPhy. (g,h: 2QFR) Purple acid phytase (PAPhy), Phaseolus vulgaris (kidney bean) PAP (no PAPhy structure available) in complex with sulfate (yellow). PAPhy are generally homodimeric and contain two metal ions involved in catalysis and creation of a favorable electrostatic potential. Shown here are Fe3þ (black) and Zn2þ (magenta). (g) One chain is colored cyan and purple (active site on reverse-side of the molecule), the other orange and green. Images created with Chimera (26) using Protein Data Bank accessions as indicated.
Emerging Changes and Challenges in Animal Agriculture
지난 세기 후반에는 효율성을 높이고 생산 비용을 낮추기 위해 돼지 및 가금류 시설의 규모가 급격히 증가했습니다(49).
동시에, 빠르게 성장하거나 생산성이 높은 돼지 및 가금류 품종이 개발되어 사료에 대두박 및 기타 식물성 사료를 많이 활용하도록 사육되었습니다(50).
어분이나 기타 동물성 단백질 공급원에 비해 대두박이 갖는 비용상의 이점은 어류 사료 공급 프로그램에도 변화를 가져왔습니다.
이러한 식물 사료에 포함된 피테이트-인 phytate-phosphorus은 쉽게 얻을 수 없기 때문에 이러한 가장 단순한 종의 인 요구 사항을 충족하려면 무기 인산염 보충의 양을 늘려야 했습니다.
활용되지 않은 사료인 피테이트-인 phytate-phosphorus은 이들 동물에 의해 대부분 배설되었으며, 이로 인해 배설물 내 인 함량이 너무 높아 농경지에 적용할 수 없게 되었습니다.
위에서 언급한 대규모 돼지 및 가금류 생산 시설의 통합은 문제를 더욱 악화시켰고 인이 풍부한 동물 배설물 유출에 대한 대중의 우려를 불러일으켰습니다.
어류 폐사를 포함하여 인 함량이 높은 동물 배설물의 환경적 악영향은 오랫동안 인식되어 왔습니다(51).
1990년대에 미국 동부 해안에서 어류 도살 빈도가 높아져 대중의 경각심을 불러일으켰습니다.
"매복 포식자"인 와편모충 Pfiesteria piscicida(52)에 대한 뉴스 기사는 정부 조사를 촉발시켰으며 심지어 동물 배설물의 인 농도를 줄이기 위한 한 가지 조치로 피타제 사용을 의무화하는 법안을 제정하기도 했습니다.
Development of Microbial Phytase as a Feed Supplement
1962년, 국제 광물 및 화학 회사(International Minerals & Chemicals, IMC)는 상업용 phytase 개발을 위한 초기 노력(4)을 기울였습니다.
이러한 노력의 일환으로 2,000개 이상의 미생물을 선별하여 phytase 생산 능력을 검증했습니다.
IMC는 동물 사료 산업에 무기태(암석) 인산염phosphates을 공급하고 있었지만 대두 및 기타 식물성 식품의 피틴산phytic acid을 가수분해하는 피타아제phytase를 시장에 내놓을 수 있는 잠재력을 예견했습니다.
육상 무기태인의 매장량은 제한되어 있고 결국에는 채굴될 것이기 때문에 이러한 예측은 참으로 미래지향적인 것이었습니다.
이 프로젝트는 1968년에 종료되었습니다.
1968년, 상업적으로 이용 가능할 만큼 충분히 높은 phytase 활성을 가진 유기체를 발견하지 못했기 때문입니다.
그러나 IMC의 선구적인 시도는 매우 귀중한 아스퍼질러스(피큠) 니거 Aspergillus (ficuum) niger NRRL 3135(ATCC 66876) 분리체를 제공했으며, 이를 통해 나중에 시판 중인 최초의 피타제 활성을 어빙과 코스그로브(53)의 초기 특성 분석 이후 1990년대에 최초로 시판된 피타제(phytase)의 동정을 가능하게 했습니다.
1980년대에 재조합 DNA 기술이 적용되면서 동물 사료용 phytase 를 개발하는 또 다른 이정표를 세웠습니다.
A. niger NRRL 3135 균주는 시장에서 허용되는 phytase 를 생산하는 이 새로운 기술의 능력을 테스트하는 데 훌륭한 후보가 되었습니다.
IMC phytase 연구팀의 일원이었던 루디 워진스키 박사는 1980년대 미국 농무부 농업연구청이 농업 관련 프로젝트에 재조합 DNA 기술을 활용하는 데 관심을 갖고 있다는 사실을 알게 된 후 이를 지원했습니다.
그의 주도로 1984년 미 농무부에서 phytase 연구 프로젝트가 시작되었습니다.
연방 정부의 지원을 받은 이 연구를 통해 Mullaney와 그의 동료(54)는 phytase 유전자(phyA)의 일부 염기서열을 최초로 복제하는 데 성공했습니다,
이후 이 유전자의 전체 서열과 과발현(55)을 복제하여 최초의 상용화된 phytase를 생산할 수 있었습니다.
세계 최초로 상용화된 파이타제인 나투포스가 1991년에 출시되었지만,
이후 15년 동안 파이타제 시장의 발전은 더디게 진행되었습니다,
대장균 pH 2.5 산성 포스파타제(AppA 및 AppA2)가 곰팡이 PhyA(29, 56)보다 더 효과적인 파이타제로 확인되기 전까지는 말이죠.
Greiner et al.(57)의 추축으로 시작된 이 중요한 이정표는,
E. coli AppA는 부분적으로 정제된 피타제 P2의 단백질 단편과의 펩타이드 서열 상동성을 기반으로 한 추정 피타제였습니다.
E. coli에 의해 생산하여 Rodriguez와 동료(29)는 실제로 appA 유전자를 복제하였다.
Pichia 파스토리스 효모 시스템에서 효소를 과잉 생산한 후 AppA 효소가 실제로 산성 포스파타제보다 피타제에 가깝다는 최초의 직접적인 증거를 제공했습니다.
그 결과, 박테리아 피타제에 대한 연구가 활발해지면서 새로운 세대의 피타제가 개발되었습니다(Table 2),
이는 사료 첨가제로서 1세대 곰팡이 파이타제보다 여러 측면에서 우수합니다.
2010년 제1회 국제 파이타제 서밋 international phytase summit에서 현재 전 세계 파이타제 시장은 전체 사료 효소 시장의 60% 이상을 차지하며 연간 3억 5,000만 달러의 가치를 지닌 것으로 추정되었습니다.
현재 돼지와 가금류의 모든 사료에 파이타제가 포함되는 비율은 약 70%입니다.
- PhyA: phytase isolated from Aspergillus (ficuum) niger NRRL 3135
- AppA: phytase isolated from Escherichia coli; with acidic pH optimum, higher catalytic efficiency, and pepsin resistance
- AppA2: phytase isolated from a strain of Escherichia coli in pig colon, with properties similar to those of AppA
- Phytase activity unit: the amount of enzyme required to release 1 mmol of phosphoric acid per minute under certain pH, temperature, and buffer conditions
'Phytase, a New Life for an “Old” Enzyme' 카테고리의 다른 글
| SUMMARY POINTS etc (1) | 2024.01.11 |
|---|---|
| GLOBAL IMPACT AND FUTURE DIRECTION (1) | 2024.01.11 |
| NEW BIOTECHNOLOGY OF MICROBIAL PHYTASES (0) | 2024.01.11 |
| APPLICATION OF PHYTASE AND RELATED ISSUES (2) | 2024.01.11 |
