| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
- Digestibility
- CTCBIO
- LAYER
- Nutrition
- Exolution
- split feeding
- Non-starch polysaccharide
- Low Protein
- BacterPhage
- CTCZYME
- egg quality
- C.P. Group
- CP Group
- bacteriophage
- Palm kernel expeller
- β-mannan
- Danish Crown
- Pig
- Diseases of Swine
- Gut health
- Phytase
- β-Mannanases
- 김인배박사
- broiler
- Disease challenge
- Beta-mannanases
- Charoen Pokphand Group
- Xylannase
- calcium availability
- β-mannanase
- Today
- Total
CTCBIO Animal Bioscience Blog
RUMINANT NUTRITION SYMPOSIUM: Improving cell wall digestion and animal performance with fibrolytic enzymes 본문
RUMINANT NUTRITION SYMPOSIUM: Improving cell wall digestion and animal performance with fibrolytic enzymes
Kwon, KiBeom 2023. 1. 9. 16:26
RUMINANT NUTRITION SYMPOSIUM: Improving cell wall digestion and animal performance with fibrolytic enzymes
A. T. adesogan,2 Z. X. ma, J. J. Romero, and K. G. arriola
Department of Animal Sciences, Institute of Food and Agricultural Sciences, University of Florida, Gainesville 32608
J.Anim.Sci.2014.92:1317 1330
doi:10.2527/jas2013-7273
Based on a presentation at the Ruminant Nutrition Symposium titled Advancements in Enhancing Cell Wall Digestibility and its Contribution Ruminant Production at the Joint Annual Meeting, July 812, 2013, Indianapolis, IN.
Corresponding author : adesogan@ufl.edu
Received October 17, 2013.
Accepted February 11, 2014.
Ⅰ. ABSTRACT
이 논문은 외인성 섬유분해효소(EFE)를 사용한 소 사료 치료에 대해 발표된 반응을 요약하는 것을 목표로 했습니다.
동물 실험에서 다양한 EFE 효능에 대한 이유를 논의하고, 반추동물 식이에서 효소 테스트 및 EFE 효능을 개선하기 위한 전략을 권장하고, 효과적인 EFE와 비효과적인 EFE 간의 단백질체적 차이를 식별합니다.
30건의 실험으로 20건의 젖소 연구를 메타 분석한 결과 젖소의 수유 능력이 약간 증가했으며 반응이 일관되지 않은 것으로 나타났습니다.
이러한 가변성은 이 백서에서 논의된 여러 효소, 사료, 동물 및 관리 요인에 기인합니다.
가변성은 반추위 섬유 소화를 최적화하는 데 필요한 외인성 글리코실 가수분해효소, 자생 반추위 미생물 및 내인성 섬유분해 효소 사이의 상승적이고 순차적인 상호작용에 대한 우리의 제한된 이해를 반영합니다.
추가된 합병증은 EFE 활동을 분석하는 많은 표준 방법이 순수한 기질 당화를 기반으로 하고 반추위 조건을 시뮬레이션하지 않기 때문에 잠재적 효과를 과대 평가하거나 과소 평가할 수 있다는 것입니다.
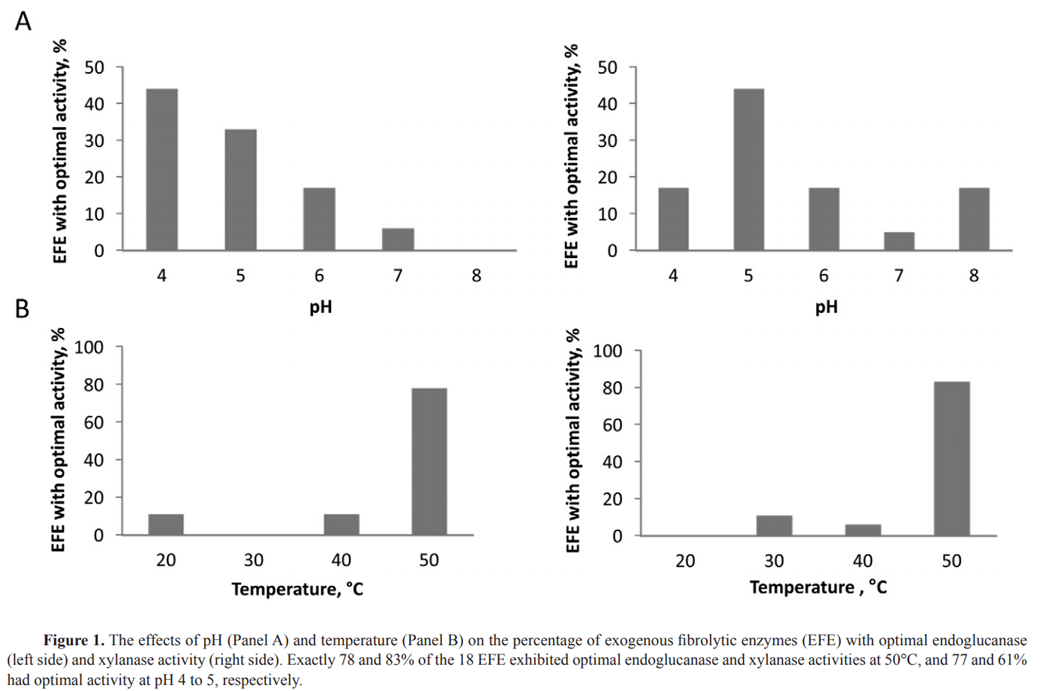
18개의 상업용 EFE에 대한 최근 평가에서 78%와 83%가 최적의 엔도글루카나제 및 자일라나제 활성을 나타냈습니다.
각각 50C에서, 그리고 77%와 61%는 각각 pH 4~5에서 최적의 활성을 나타냈으며, 이는 대부분이 반추위에서 차선책으로 작용할 가능성이 있음을 나타냅니다.
건초 섬유질을 분해하기 위해 상승적으로 작용하는 많은 섬유분해 활동 중에서 일반적으로 분석되는 몇 가지, 일반적으로 엔도글루카나아제 및 자일라나아제는 반추위 섬유질 분해의 주요 제약 요소인 다루기 힘든 페놀산-리그닌 결합을 가수분해할 수 없습니다.
이러한 요소는 식단에 EFE를 무작위로 추가하는 것이 무익함을 강조합니다.
이 논문은 섬유 분해 효소의 식이 첨가에 대한 다양한 동물 반응에 대한 이유를 논의하고, 불일치에 대한 설명을 발전시키고, 반추동물 식이에서 효소 효능을 개선하기 위한 전략을 제안하고, 효과적인 EFE와 비효과적인 EFE의 프로테옴 간의 차이점을 설명합니다.
Key words: cellulase, cofactor, cow, endoglucanase, lignocellulose, plant cell wall, xylanase
Ⅱ. Introduction
건초는 반추 동물의 주요 사료 공급원이며 미국에서 각각 젖소와 육우 배급량의 약 61%와 83%를 차지합니다(Barnes and Nelson, 2003).
그러나 중간에서 높은 섬유질 함량은 소화율을 감소시키고 동물 생산성을 제한합니다.
반추동물 가축의 사료 품질을 개선하기 위해 물리적 제제(열, 증기 및 압력과 같은 산, 알칼리, NH3 및 오존과 같은 화학 물질)를 사용 포함하여 백색부후균과 같은 생물학적 작용제 또는 자연 선택, 육종 또는 분자 공학을 통한다양한 전략이 시도되었습니다.
그러나 이러한 방법 중 어느 것도 마초 품질 및 반추 동물 성장을 개선하는 데 널리 사용되지 않습니다.
이것은 증기 또는 압력 폭발과 같은 물리적 방법의 자본 및 에너지 집약적 특성, 반추위 산의 타액 완충을 제한하기 위한 펠릿화, 절단 또는 분쇄 가능성, NH3 및 NaOH와 같은 백부후균에 의한 가수분해 후 과도한 DM 손실 가능성과 같은 화학 물질의 비용 및 부식성 및/또는 유해 특성, 육종 접근법의 장기화 특성(FAO, 2011; Lynch et al., 2013). 때문입니다.
지난 20년 동안 외인성 섬유분해 효소(EFE)를 사용하여 마초 품질과 반추 동물 성능을 개선하는 데 공동의 노력을 기울였습니다.
이 논문은 EFE로 소 사료 첨가 것에 대해 발표된 반응을 요약하고, 동물 실험에서 다양한 효능에 대한 이유를 논의하고, 프로테오믹스를 사용하여 비효과적인 EFE와 효과적인 EFE의 차이점을 이해하고, 반추 동물 사료에서 EFE 효능을 개선하기 위한 전략을 권장하는 것을 목표로 합니다.
Ⅲ. META-ANALYSIS
젖소의 사료에 EFE를 추가한 결과를 요약하기 위해 메타 분석을 수행했습니다(A. T. Adesogan, K. G. Arriola 및 M. Giurcanu, University of Florida, 개인 서신).
이 연구는 20개 연구와 30개 실험의 데이터를 평가했습니다.
동물 영양에 사용되는 EFE의 주요 활동의 가변성으로 인해 성능 측정에 대한 EFE 적용의 전반적인 영향을 결정하는 것은 부적절한 것으로 간주되었습니다.
오히려 성과 측정에 대한 연구 저자가 나열한 주요 EFE 활동의 효과가 결정되었습니다.
처리는 적용 방법(건초, 농축액 또는 총 혼합 비율[TMR]에 대한)의 요인 조합과 적용률의 상호 작용 및 저자가 나열한 주요 EFE 활동이었습니다.
후자는 셀룰라아제-자일라나아제, 아밀라아제, 셀룰라아제-자일라나아제-아밀라아제, 셀룰라아제-글루코스 옥시다아제-락토바실러스, 셀룰라아제-글루코오스-옥시다아제-락토바실러스-아밀라아제, 페룰산 에스테르-효소, 셀룰라아제-페룰산 에스테라아제, 자일라나아제-엔도글루카나아제-엑소글루카나아제, 및 엔도글루카나제-자일라나제, 및 프로테아제.
비섬유분해 활성(예: 아밀라아제 및 프로테아제) 또는 락토바실러스(즉, Lactobacillus plantarum 및 Pediococcus acidilactici)를 포함하는 복합효소제 포함 기준을 충족하는 연구가 거의 없었기 때문에 포함되었습니다.
건물 섭취량은 amylase, cellulase-xylanase, cellulase-xylanase-amylase, ferulic acid esterase에 의해 증가(P < 0.05)한 반면(Table 1), 반면, 우유 생산량과 사료 효율은 각각 cellulase-xylanase와 endoglucanase-xylanase에 의해서만 증가되었다(P < 0.05).
따라서 소수의 EFE만이 동물 성능을 향상시켰습니다.
이것은 EFE가 소의 성과에 미치는 영향이 모호하다는 결론을 내린 리뷰에 동의합니다(Beauchemin et al., 2003; Adesogan, 2005).
Table 1. Effect of application of applying various exogenous fibrolytic enzymes(EFE) at different rates on performance of lactating dairy cows(from A. T. Adesogan, K. G. Arriola, and M. Giurcanu, University of Florida, personal;communication)

⚫ 외인성 섬유분해 효소 급여에 과한 모호한 효과의 원인
다음은 EFE 적용에 대한 일관성 없는 효과에 대한 원인의 일부 목록입니다.
◆ 수유의 잘못된 단계에서 젖소 사용.
연구 중 일부는 수유기 중기 또는 후기의 젖소를 대상으로 했습니다.
효소 연구는 젖소의 더 많은 에너지 요구로 인해 효소 효과의 감지 가능성이 더 높은 수유 초기에 시작해야 합니다.
Schingoethe et al.(1999)은 우유(Dim)에서 100일 이하 또는 그 이상인 젖소의 식이 EFE 적용에 대한 우유 생산 반응을 비교했습니다.
EFE는 100 DIM 미만의 젖소에서 우유 생산량을 10% 증가시켰지만 100 DIM보다 큰 젖소에게는 영향을 미치지 않았습니다.
◆ 부적절한 실험 설계 및/또는 기간 사용.
10주 연속 디자인(Holtshausen et al., 2011) 또는 21일 주기의 3 × 3 라틴 스퀘어 디자인(Chung et al., 2012)을 포함하는 두 가지 연구에 동일한 식단, EFE 및 EFE 배치를 사용하여 캐나다 Lethbridge의 농업 및 농식품에서 동일한 연구원에 의해 수행되었습니다.
효소 처리는 전자의 연구에서 DMI(건물섭취량)를 감소시키고 사료 효율을 증가시켰지만 후자의 연구에서는 성능에 영향을 미치지 않았다.
따라서 단기간 전환 설계는 EFE 처리에 대한 성능 반응을 측정하는 데 적합하지 않습니다.
또한 우유 생산은 EFE로 처리된 사료를 최소 3주 동안 먹일 때까지 영향을 받지 않을 수 있습니다(Schingoethe et al., 1999; Romero, 2013).
◆ 부적절한 효소 선택.
일부 EFE는 직물, 식품, 반추동물 사료 또는 종이와 같은 다른 용도로 개발되었습니다.
따라서 이러한 EFE는 종종 섬유질 반추 동물 사료의 사용을 개선하기 위한 충분한 효능과 특이성이 부족합니다.
특히,이러한 EFE의 최적 pH 및 온도는 반추위와 상당히 다른 경우가 많습니다.
최근 pH 3, 4, 5, 6, 7에서 5개사 18개 EFE의 endoglucanase(Enzyme Commission [EC] 3.2.1.4)와 xylanase(EC 3.2.1.8) 활성을 일정한 온도(39°C, Figure 1A) 또는 20, 30, 40, 50°C, 일정한 pH 6에서(Figure 1B, Arriola et al., 2011b) 비교하였다.
정확하게 18개 EFE는 50°C에서 78%와 83%의 최적의 endoglucanase와 xylanase 활성을 나타냈고, 77%와 61%는 각각 pH 4~5에서 최적의 활성을 보였습니다.
따라서 대부분은 반추위 조건에서 최적이 아닌 활동을 보일 것입니다.
Viciniet al. (2003)은 소에서 동일한 EFE의 효능에 대한 가장 포괄적인 공개 테스트 중 하나를 수행했습니다.
그들은 미국의 4개 지역에서 257마리의 젖소와 영국의 1개 지역에서 122마리의 젖소를 대상으로 한 실험에서 2 EFE의 식이 적용 효과를 조사했습니다.
위에서 두가지 EFE 공급은 모두 수유 능력에 영향을 미치지 않았으며 이는 어느 쪽도 반추위 조건에서 최적의 활성을 나타내지 않는다는 사실에 부분적으로 기인합니다.
오히려 우리 연구에서와 같이 최적의 활동은 pH 4~5 및 50°C에서 발생했습니다.
Colombatto et al 이 지적한 바와 같이 최적의 pH에서 EFE의 안정성도 중요합니다. (2004).
우리는 최근 반추위 조건에서 배양 24시간 이내에 18 EFE의 endoglucanase 활성의 90% 이상이 소실된다는 것을 발견했습니다.
Trichoderma reesei(anamorph of Hypocrea jecorina)는 셀룰라아제 생산을 위한 기준 유기체이며 셀룰라아제의 가장 일반적으로 사용되는 상업적 공급원입니다(Paloheimo et al., 2011; Glass et al., 2013).
대량의 셀룰라아제와 헤미셀룰라아제를 생산하고 셀룰로오스를 효율적으로 분해하는 능력 때문일 가능성이 높습니다.
그러나 pH 5에서 최대 셀룰로오스 분해 효율을 나타냅니다(Adav et al., 2011; Glass et al., 2013).
따라서 반추위 조건에서 분해 효율이 높은 다량의 셀룰라아제를 분비하는 대체 미생물이 필요합니다.
대부분의 미생물 자일라나제는 중온성 온도(즉, 40~60°C)와 pH 4~6에서도 작용합니다(Paloheimo et al., 2011).
많은 것이 반추위 섬유 분해를 최적화하는 데 이상적이지 않음을 나타냅니다.
대부분의 고전적인 섬유분해 효소 활성 분석은 효소 활성을 최적화하지만 반추위의 조건과 다른 조건(즉, pH 4~5 및 50°C; Ghose, 1987)에서 수행됩니다.
그러나 위에서 설명한 연구는 이 접근법이 대부분의 EFE의 반추위 가수분해 잠재력을 과대평가할 것임을 보여줍니다.
그 효과를 최적화하기 위해 이러한 EFE는 이상적으로는 상대적으로 뜨거운 조건(즉, 약 50°C)에서 낮은 pH(즉, 4~5)에서 엔실링 또는 저장 중에 사료에 첨가되어야 합니다.
그러나 이러한 EFE를 사일리지에 첨가하면 생성된 당이 VFA로 발효되어 사일리지에서 발효 가능한 ME의 공급이 감소할 수 있습니다.
따라서 연구 노력은 새롭고 강력하며 안정적인 EFE를 발견하거나 반추위에서 최적의 활성을 나타내고 유지하기 위해 이미 존재하는 EFE를 엔지니어링하는 데 전념해야 합니다.
◆ 부적절한 통계력.
발표된 EFE 연구 중 일부는 치료 효과를 감지하기에는 통계적 검정력이 불충분했습니다.
적절한 검정력은 생물학적 첨가제를 검사할 때 특히 중요합니다.
반응은 긍정적이지만 때로는 작기 때문입니다.
◆ 외인성 섬유분해 효소 활동의 부적절한 검사 및 사용.
셀룰라아제 활성 특성화는 천연 셀룰로오즈가 불용성이고 구조적으로 가변적이어서 농도와 화학적 형태에 대해 상대적으로 정의되지 않기 때문에 다른 효소에서는 거의 발생하지 않는 독특한 문제를 제기합니다(Ghose, 1987).
또한, 셀룰로오스 가수분해는 상승작용으로 작용하는 다수의 엔도글루카나제 및 엑소글루카나제를 포함하며, 피드백 제어의 다양한 메커니즘을 가진 다양한 산물 및 트랜스글리코실화 종과 관련하여 여전히 잘 이해되지 않는 복잡한 방식으로 작용합니다(Ghose, 1987).
또한, 고전적인 섬유분해 효소 활성에 사용되는 대부분의 기질은 EFE가 적용되는 건초 및/또는 사료와 다릅니다.
따라서 그러한 활동이 NDF 소화율(nDFD)에 대한 중간(R2 ≤ 0.56; corn silage; Eun and Beauchemin, 2008)에서 불량(R2 ≤ 0.06; bermudagrass silage ; Romero et al., 2011a) 예측을 생성한 것은 놀라운 일이 아닙니다.
이는 젖소 섭취량과 성과의 주요 예측 인자입니다(Jung과 Allen, 1995; Oba와 Allen, 2000).cellulase 및 xylanase 활성 분석의 표준화 부족과 다른 단위로 결과를 표현하는 것도 이 분야의 발전을 방해했습니다.
Colombatto 및 Beauchemin(2003)에서 권장하는 분석법을 사용하여 EFE 활성 테스트를 표준화해야 합니다.
◆ 부정확한 효소 지정/명칭
반추 동물 사료 산업에서 사용되는 상업용 EFE는 일반적으로 여러 가지 다른 효소 활동을 포함하는 원유 또는 반정제 추출물입니다.
일반적으로 제품 라벨에는 주요 활동만 표시되며 대부분의 경우 셀룰라아제 활동(cellulase activity)입니다.
"cellulase"라는 용어는 단일 효소 활성을 나타내는 것처럼 일반적으로 이러한 라벨 및 동물 영양 용어로 자주 사용됩니다.
그러나 "cellulase"는 셀룰로오스를 가수분해 할 수 있는 여러 효소를 의미하는 일반적인 용어이지만 이들은 일반적으로 구조, 출처 및 기능이 다릅니다.
실제로 포괄적인 효소 데이터베이스 시스템(www.brenda-enzymes.org)인 BRENDA에서 "셀룰로오스"를 검색하면 64개의 항목이 반환됩니다.
β-glucosidase 또는 cellobiose phosphorylase와 같은 특정 효소는 각각 cellobiose 대사 및 셀룰로오스 가수분해 향상에 필요합니다.
그러나 실제로는 셀룰라아제가 아니므로 그림이 더욱 복잡해집니다(Ghose, 1987).
결과적으로 기술적으로는 정확하지만 효소 제제의 셀룰라아제 활성을 언급하는 것은 부정확한 지정이며 용어를 계속 사용하면 섬유질 분해 및 동물 성능을 향상시키는 가장 강력한 효소를 개발하는 데 방해가 될 것입니다.
International Union of Biochemistry 의 효소 지정을 참조하는 것이 더 정확합니다(Bairoch, 2000).
예를 들어, 엔도글루카나제, EC 번호 및 글리코시드 가수분해효소 계열(GHe).
EC 번호는 효소에 의해 촉매되는 반응 유형을 기반으로 합니다.
예를 들어, EFE의 주성분은 가수분해효소입니다.
처음에 국제 생화학 및 분자 생물학 연맹은 기질 특이성 기질 특이성 및 때때로 분자 메커니즘에 기반하여 GHe로 명명했습니다.
그러나 CAZy 웹사이트(www.cazy.org)에서 볼 수 있듯이 일부는 단백질 접힘과 아미노산 서열 유사성에 따라 GHe를 클랜으로 분류했습니다.
엔도글루카나제 활성(EC 3.2.1.4)은 5, 6, 7, 8, 9, 26, 44, 45, 48, 51, 74 및 124를 포함한 여러 GHe 계열에 존재합니다(Lombard et al., 2013).
Knutt(2006)의 문헌 검토에서 언급한 바와 같이, T. reesei의 secretome에는 다음과 같은 엔도글루카나아제가 존재합니다.
1) 전체 셀룰로오스의 5~10%를 차지하는 주요 엔도글루카나아제인 엔도글루카나아제 I(GHe 7; cellulase [Cel] 7B),
2) 엔도글루카나제 II(GHe 5; Cel 5A)는 엔도글루카나제 I과 비슷한 양으로 생산되지만 치환된 셀룰로오스 및 β-글루칸에 대한 활성이 약간 적습니다.
3) 셀룰로오스 결합 모듈이 없지만 β-1,3–1,4 글루칸, 자일로글루칸 및 자일란을 가수분해할 수 있는 작은 효소인 엔도글루카나제 III(GHe 12; Cel 12A),
4) 이전에 GHe 61 계열(Cel 61A)로 분류되었으나 지금은 보조 활성 계열 9(aa9)에 속하는 엔도글루카나제 IV는, Cu 의존성 다당류 모노옥시게나제의 새로운 부류를 나타내고 가수분해보다는 산화-환원 반응에 의해 작용하고(Harris et al., 2010; Quinlan et al., 2011) 다른 셀룰라아제로 발현이 유도되기 때문입니다.
5) 엔도글루카나아제 V(GHe 45; Cel 45A), 엄격한 엔도글루카나아제는 아니지만 약간의 셀룰로오스 분해 활성을 나타내며 글루코만난을 쉽게 가수분해합니다.
상업적으로 관련된 T. reesei 엔도글루카나아제는 엔도글루카나아제 I/Cel 7B, 엔도글루카나아제 II/Cel 5A 및 엔도글루카나아제 III/Cel 12A입니다(Paloheimo et al., 2011).
◆ 유기체에 의한 외인성 섬유분해 효소 작용 및 분비 방식에 대한 제한된 이해.
효소는
반추위 통과율을 증가시킴으로써,
반추위 미생물 수 및/또는 부착을 증가시킴으로써,
반추위 미생물을 자극하고 소화액 점도를 감소시킴으로써(Morgavi et al., 2000; McAllister et al., 2001; Beauchemin et al., 2004b)
반추위 섬유 가수분해, 소화 및 분해의 속도와 정도를 증가시켜 사료 사용을 촉진할 수 있습니다.
그러나 셀룰로오스는 식물 세포벽 내에서 분해하기 가장 어려운 물질입니다(Glass et al., 2013).
따라서 수많은 효소가 셀룰로오스 분해에 기여합니다.
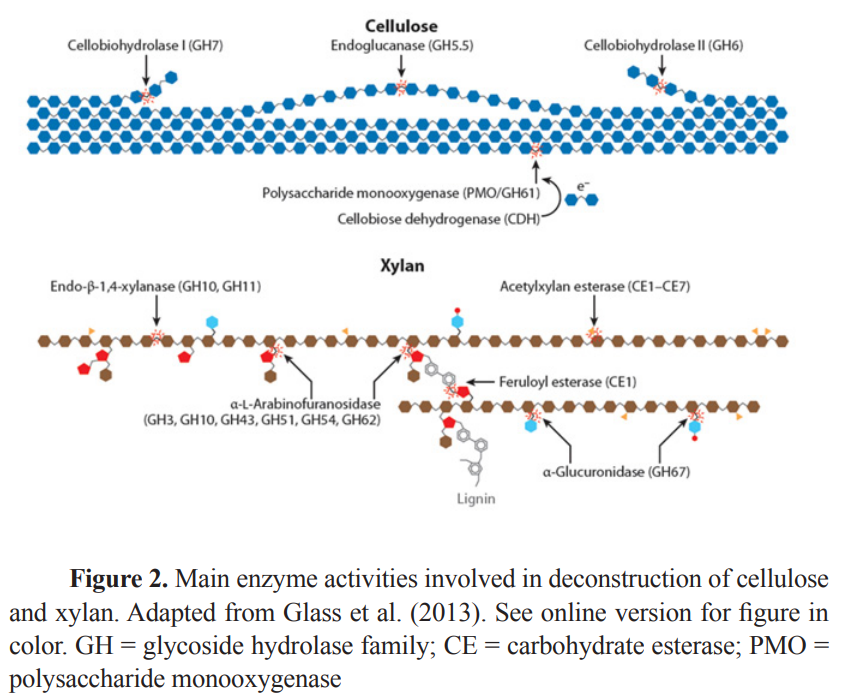
고전적 도식(Figure 2; Bhat and Hazlewood, 2001; Beauchemin et al., 2003; Glass et al., 2013)은 다음과 같습니다.
글루코스 사슬에서 내부 글리코시드 결합을 절단하는 엔도-1, 4-β-글루카나제(EC 3.2.1.4;GHe 5, 6, 7, 8, 9, 10, 12, 16, 18, 19, 26, 44, 45, 48, 51, 74, and 124), 이 효소는 카르복시메틸 셀룰라아제, β-1,4-글루칸 글루카노하이드롤라아제 및 엔도글루카나아제로도 알려져 있습니다.
엑소-β-1, 4-글루카나제, 또한 엑소셀룰라아제 또는 셀로바이오하이드롤라아제(CBH)로도 알려져 있습니다.
셀룰로오스 사슬의 환원 말단(엑소글루카나아제 1; EC 3.2.1.176; GHe 7, 9, and 48; CBH 1/Cel 7) 또는 비환원 말단(엑소글루카나아제 II; EC 3.2.1.91; GHe 5, 6, 7, and 9; CBH 1/Cel 6)에 있는 글루코스 단위 사이의 글리코시드 결합을 절단하여 주로 셀로비오스 및 다양한 중합을 갖는 셀룰로오스 올리고머를 생성합니다.
베타-글루코시다제(EC 3.2.1.21; GHe 1, 3, 5, 9, 30 및 116), 그리고 환원 말단과 비환원 말단 모두에서 단쇄 셀로올리고당과 셀로비오스를 모노머 글루코스 단위로 가수분해합니다.
이 효소는 셀룰라아제 β-1,4-셀로바이오시다아제, β-글루코시다아제 또는 셀로비아아제로도 알려져 있습니다.
헤미셀룰로스 분해는 또한 헤미셀룰로스 골격에 연결된 다양한 측쇄 및 화합물로 인해 매우 복잡합니다.
xylan backbone을 가수분해하는 것과 관련된 주요 활동은 Figure 2에 나와 있습니다.
여기에는 xylan 가수분해에서 xylooligomers를 생성하는 endoxylanases와 같은 xylanase(EC 3.2.1.8) 및 xylose를 생성하는 β-1,4-xylosidase(EC 3.2.1.37)가 포함됩니다(Bhat and Hazlewood, 2001; Beauchemin et al. , 2004a).
xylan backbone의 측쇄 분해에 관여하는 효소로는 β-만노시다제(EC 3.2.1.25), α-L-아라비노푸라노시다제(EC 3.2.1.55), α-D-글루쿠로니다제(EC 3.2.1.139), α-D-갈락토시다제(EC 3.2.1.22), 아세틸자일란 에스테라제(EC 3.1.1.72) 및 페룰산 에스테라제(EC 3.1.1.73; White et al., 1993; Bhat and Hazlewood, 2001)가 있습니다.
이러한 설명은 여러 효소가 세포벽을 분해하기 위해 어떻게 작용하는지 설명하지만 서로 다른 종의 효소 시스템의 차이를 특징짓지는 않습니다.
Ghose(1987)는 다양한 유기체의 셀룰라아제 시스템의 작용 방식에서 상대적 차이에 대한 설명이 거의 없다고 지적했습니다. 특히 진핵생물과 원핵생물 사이에서.
이 문제를 다루는 최근 연구에 따르면 T. reesei에서 CBH 1/Cel 7A 및 CBH 2/Cel 6A는 각각 셀룰로오스 유도 조건에서 총 분비 단백질의 약 60% 및 20%를 차지하며(Glass et al., 2013 )
반면에 Neurospora crassa에서는 secretome의 65%가 4개의 단백질(CBH 1, GHe 6-2, GHe 5-1 및 GHe 3-4; Phillips et al., 2011; Glass et al., 2013)로 구성되어 있습니다. .
Glass et al(2013)은 또한 GHe 61 계열의 구성원을 암호화하는 유전자의 수는 사상균 사이에서 매우 다양하며 GHe 61 유전자의 발현 수준은 단순히 게놈에 존재하는 수와 상관관계가 없다고 지적했습니다.
그들은 N. crassa가 고도로 확장된 폴리옥사이드 모노옥시게나제(GHe 61) 계열을 가지고 있음을 보여주는 연구를 인용했습니다.
이것은 유기체에 의한 셀룰로오스 분해에 중요한 반면, 이 패밀리는 T. reesei 및 Aspergillus niger에서 감소됩니다.
또한 N- 또는 C-말단 셀룰로오스 결합 모듈(CBm; 이전에는 셀룰로오스 결합 도메인[CBD]라고 함)의 존재와 관련하여 곰팡이 효소와 박테리아 효소 간에 차이가 있습니다.
대부분의 곰팡이 효소에는 CBM이 있습니다.
셀룰로오스에 대한 결합 친화력을 나타내고 무정형 또는 결정 셀룰로오스와 같은 불용성 기질과 효소의 회합을 강화하지만 카르복시메틸 셀룰로오스와 같은 가용성 기질의 가수분해에는 필수적이지 않습니다(Tomme et al., 1995; Suurnäkki et al., 2000, Paloheimo et al., 2011).
셀룰로오스 가수분해에 대한 CBM의 중요성과 T. reeseii와 같은 진균 및 Bacillus spp.와 같은 박테리아의 분비물의 주요 효소에 CBM 모듈이 존재함에도 불구하고, 일부 진균 및 박테리아의 셀룰라아제 시스템에는 존재하지 않습니다(Paloheimo et al., 2011).
셀룰로오스 분해 유기체의 셀룰라아제 시스템의 또 다른 주요 차이점은 호기성 박테리아 및 진균과 달리(Paloheimo et al., 2011) 특정 혐기성 반추위 박테리아는 반추위 섬유소 소화에 중요한 역할을 하는 셀룰로솜을 합성하지만 다른 박테리아는 그렇지 않다는 것입니다.
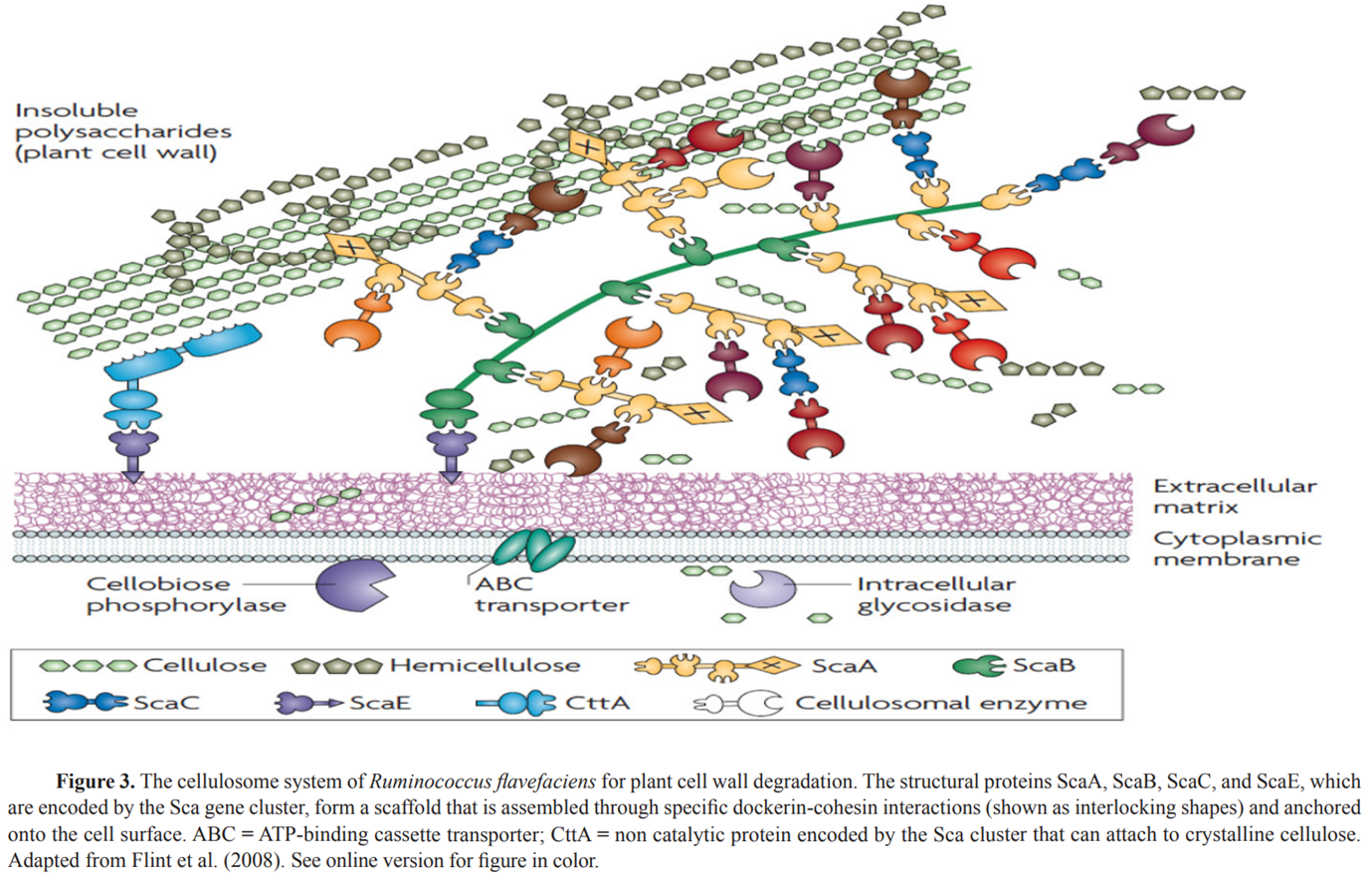
Flint et al.(2008)은 셀룰로좀을 혐기성 셀룰로스 분해 박테리아에서 발견되는 분리된, 세포외, 다성분, 다효소 복합체로 설명했습니다.
이는 식물 세포벽의 다루기 힘든 셀룰로오스 기질과 헤미셀룰로오스 기질을 효율적으로 분해하기 위해 서로 다른 상주 효소 사이에 강화된 시너지 활성을 제공합니다.
그들은 Ruminococcus flavefaciens의 셀룰로좀을 설명했고(Figure 3) 중추적인 비촉매 소단위인 scaffoldin이 모듈간 cohesion-dockerin interaction을 통해 다양한 효소 소단위를 복합체로 고정시킨다는 점에 주목했습니다.
R. flavefaciens와 Fibrobacter succinogenes 모두 반추위 세포 분해에 중요한 역할을 하지만 F. succinogenes에는 셀룰로솜이 없습니다(Flint et al., 2008).
오히려 현재 알려지지 않은 기능을 가진 일련의 단백질을 통해 셀룰로오스 분해에 영향을 미칩니다(Morrison et al., 2009).
셀룰로솜은 그 역할을 더 잘 이해하기 위한 다양한 노력에도 불구하고(Rincon et al., 2004; Kang et al.,2006년; Bayer et al., 2008).
전술한 내용은 반추위 셀룰라아제의 복잡성을 설명하고 다양한 유기체의 셀룰라아제 시스템과 셀룰라아제의 차이점을 강조합니다.
마찬가지로 자일라나아제는 당분해, 단백질 분해, 자가 응집 또는 다른 다당류와의 응집과 관련하여 다릅니다(Paloheimo et al., 2011).
◆ 효소 활동에 영향을 미치는 요인에 대한 제한된 이해.
일부 리뷰(Beauchemin et al., 2003, 2004a; Adesogan, 2005)는 어떤 요인이 영향을 받는지 설명했습니다
효소 활성이 유형, 소스 및 활성과 같은 효소 요인
EFE에 대한 특이성, 형태, 산도 또는 알칼리도, 수분 활성도와 같은 공급 요인,
EFE 적용률, 섭취와 관련된 EFE 적용 시기, 표적 식이 성분 및 EFE가 적용되는 식이의 비율과 같은 관리 요인,
성장 수준 및 수유 단계와 같은 동물적 요인.
또한, 반추위 EFE 활성은 효소가 반추위 분해에서 살아남는 정도에 의해서도 결정됩니다.
글리코실화된 EFE와 높은 비율의 이황화 교차 결합을 가진 EFE는 이러한 속성이 없는 것보다 반추위 분해에서 살아남을 가능성이 더 높습니다(Broderick et al., 1991; Morgavi et al., 2000).
다음의 추가 요인은 효소 활성에 영향을 미치는 일반적인 요인이지만, 반추위 섬유질 분해에 관여하는 EFE의 활성에 미치는 영향은 충분히 이해되지 않고 있습니다.
◆ 코엔자임 및 보완 시너지 효소.
많은 저자들은 EFE가 사료의 촉매 특성을 반영하여 사료의 분해 속도를 증가시킴으로써 작용한다고 지적했습니다(Wang and McAllister 2002; Beauchemin et al., 2004b).
그럼에도 불구하고 몇몇 연구에서는 EFE가 생체 내 DM 소화율(DmD) 및/또는 NDFD의 증가로 입증된 것처럼 소화 정도도 증가시킨다는 것을 보여주었습니다(Krueger et al., 2008; Arriola et al., 2011a; Romero et al., 2013c).
후자는 반추위 소화관에서 부재, 억제 또는 비활성화된 보조 효소 또는 EFE의 보완적 활동의 존재를 반영할 수 있습니다. 예를 들어, 최근 연구에서는 다당류 모노옥시게나제가 셀룰라아제의 활성을 향상시킬 수 있음을 보여주었습니다(Glass et al., 2013).
또한 GHe 4 및 109는 니코틴아미드 아데닌 디뉴클레오타이드 보조인자를 필요로 하는 가수분해 메커니즘을 사용하는데, 이는 촉매작용 내내 단단히 결합된 상태를 유지합니다(Withers and Williams, 2013).
◆효소-기질 상호작용.
효소-사료 특이성은 효소 활성의 중요한 결정 요인이다(Beauchemin et al., 2003).
이러한 특이성은 기질과 효소 활성 부위의 구조가 상보적일 때 촉매 작용이 일어난다는 "잠금 및 열쇠 메커니즘" 이론에 의해 설명됩니다.
그러나 이 이론은 효소 전이 상태의 안정성을 설명하지 못하기 때문에 "유도 적합 이론"이 제안되었습니다.
이는 효소의 활성 부위의 구성이 기질을 수용하도록 변형될 때 효소 촉매 작용이 발생함을 나타냅니다.
알로스테릭 효소에 이펙터를 부착하면 활성 부위를 수정하여 기질을 반발하거나 수용하여 촉매작용을 촉진하거나 방지할 수 있습니다.
소 사료에 사용되는 EFE의 활동에서 효소 이펙터의 역할은 해명되지 않았습니다.
◆효소 조절 및 향상.
다양한 pH 및 온도에서 EFE의 최적 활성을 조사한 몇 가지 연구 외에도, 효소 분비와 작용을 조절하는 조절자의 역할을 이해하고 활용하는 데 상대적으로 거의 관심을 기울이지 않았습니다.
예를 들어, 최근 연구에 따르면 T. reesei에서 셀룰로오스 분해 반응을 매개하는 신호 캐스케이드가 종종 빛 의존 방식으로 작용하는 것으로 나타났습니다(Glass et al., 2013).
다른 연구에서는 식물 세포벽 익스팬신과 유사한 스웰레닌과 같은 부속 단백질이 비가수분해 메커니즘을 통해 셀룰로오스를 파괴하여 EFE에 의한 기질 접근성을 향상시킬 수 있다고 제안했습니다.
그러나 이들의 생화학적 작용은 아직 완전히 설명되지 않았다(Jäger et al., 2011; Glass et al., 2013).
EFE 활성의 추가적인 잠재적 조절인자는 보조인자, 활성제, 및 추가 효소적 가수분해를 억제하는 다른 화합물 또는 촉매 최종 생성물과 같은 억제제를 포함한다.
예를 들어, Quinlan et al(2011)은 중요한 셀룰라아제 강화 인자인 AA9(이전 GHe 61) 계열 다당류 모노옥시게나아제의 최대 활성을 위해 Cu-금속효소가 필요함을 보여주었습니다.
우리는 최근 건초 NDF의 섭취 전 가수분해와 NDFD에 대한 보조 인자 유무에 관계없이 EFE를 추가하는 효과를 조사했습니다(Romero et al.,2013a,b).
BRENDA 효소 데이터베이스를 검색하여 순수한 기질에서 섬유분해 효소의 활성을 개선한 보조 인자를 찾고 유망한 후보 물질(즉, Mn2+, Co2+, Fe2+, Ca2+ 및 Mg2+)을 5개의 EFE 기질 현탁액에 추가하는지 여부를 조사하여 테스트했습니다. 각 EFE 단독 사용에 비해 EFE의 가수분해 효과가 개선되었습니다.
세포벽 당화(즉, 수용성 탄수화물 방출)는 EFE를 1개만 제외하고 모두 첨가함으로써 증가되었습니다.
EFE에 대한 보조인자 추가는 특정 EFE-보조인자 조합에 따라 당화를 3~38%까지 추가로 증가시켰습니다(Table 2).
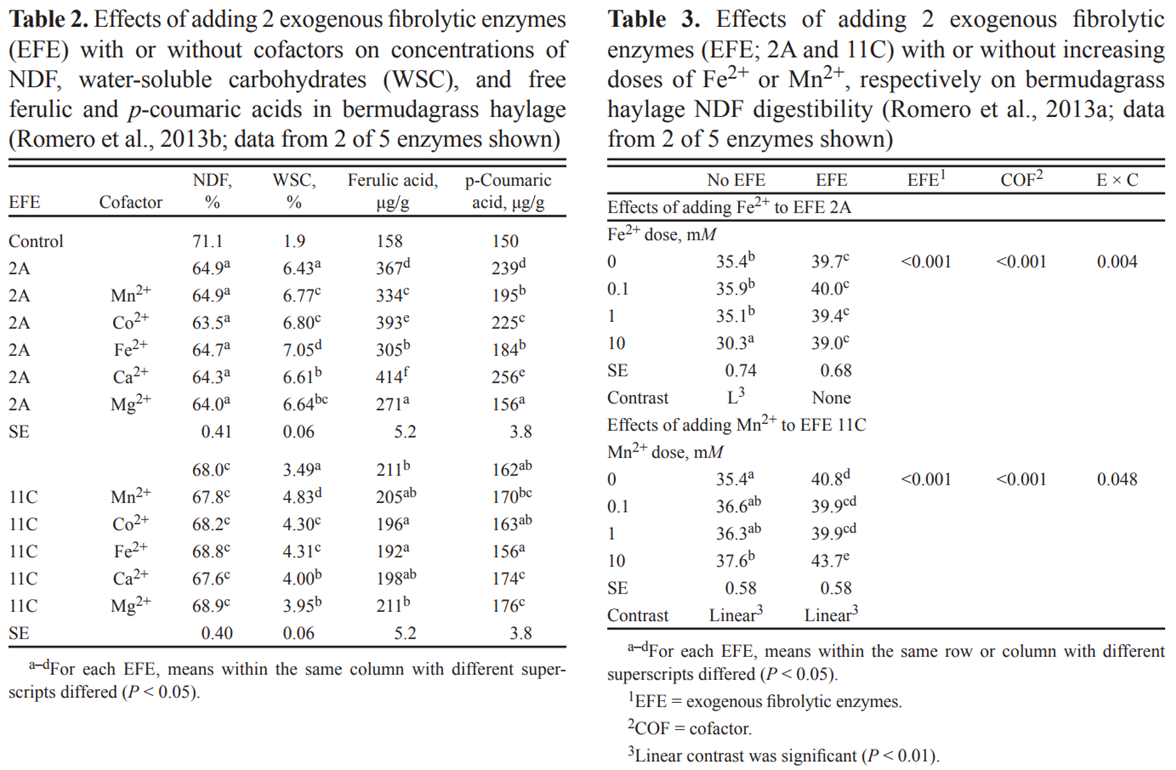
유리 페룰산 농도는 EFE를 1개만 제외하고 모두 추가하여 증가했습니다.
EFE에 보조 인자를 추가하면 최대 13%까지 추가로 증가하거나 반응에 영향을 주지 않거나 감소했습니다.
후속 연구에서는 가장 유망한 보조 인자(즉, Mn2+ 및 Fe2+)의 다른 용량(즉, 0, 0.1, 1 및 10mM)을 추가하여 EFE 매개 NDFD 증가에 미치는 영향을 조사했습니다(Table 3).
EFE 2A 없이 Fe2+ 적용 비율을 증가시키면 NFD가 선형으로 감소하지만 EFE가 있는 경우에는 효과가 없었습니다.
대조적으로, EFE 11C의 유무에 관계없이 Mn2+ 용량을 증가시키면 NDFD가 선형적으로 증가했습니다(P < 0.01).
가장 큰 반응은 EFE와 함께 10mM Mn2+를 적용했을 때 발생했으며, 이는 EFE 11C 단독 첨가로 인한 15.3% 증가보다 NDFD를 추가로 8.2% 증가시켰습니다.
그러나 10mM의 Mn2+만 추가하면 NDFD가 6.2% 증가할 뿐입니다.
결과는 특정 EFE가 반추 동물의 금속 독성 문제를 줄이는 데 사용될 수 있지만 다른 것들은 NDFD를 증가시키기 위해 특정 보조 인자와 상승적으로 작용할 수 있음을 나타냅니다.
반추 동물 영양에 사용되는 EFE의 활성에 대한 보조 인자, 보효소, 활성제 및 억제제의 역할을 밝히기 위해서는 더 많은 연구가 필요합니다.
◆;세포벽 저항성에 대한 제한된 이해.
;
섬유 소화를 최적화하려면 여러 섬유 분해 효소 간의 공동 상승 및 아마도 순차적인 상호 작용이 필요합니다.
그러나 자주 분석되는 몇 가지 효소, 일반적으로 셀룰라아제 및/또는 자일라나아제는 더 큰 반추위 섬유질 분해에 대한 주요 제약인 다루기 힘든 하이드로신남산-리그닌 연결(hydrocinnamic acid-lignin linkages)을 가수분해할 수 없습니다.
이관능성 하이드록시신나메이트(ferulic acid, p-coumaric acid 및 sinapic acid)는 리그닌과 에스테르 또는 에테르 결합을 형성할 수 있지만 다당류와는 에스테르 결합만 형성합니다(Ralph and Helm, 1993).
각각 에스테르 및 에테르 결합을 통해 아라비노자일란과 리그닌 사이에 형성된 페라레이트 가교결합, 세포벽 소화 정도를 극적으로 감소시키고(Jung and Deetz, 1993; Grabber et al.,1998a,b) 이러한 가교는 세포벽 접근성, 확장성, 가소성, 소화성 및 부착성에 현저한 영향을 미칩니다(Hatfield et al.,1999).
에테르 결합은 페룰산 에스테라아제, 일반적으로 분석되는 EFE 활성, 또는 혐기성 유기체 또는 이들의 효소에 의해 절단될 수 없습니다.
페룰산 에스테라제는 페룰산 단량체와 아라비노자일란 사이의 에스테르 결합을 가수분해할 수 있습니다.
다당류 가수분해는 아라비노자일란의 페룰산 에스테르가 기질과 자일라나아제의 정렬을 방해하여 에스테르화되는 다당류의 소화를 방해하는 경우 실제로 예방될 수 있습니다(Gorbacheva and Rodionova, 1977; Mitsuishi et al.,1988).
대안적으로, 리그닌 중합체가 페룰레이트 에스테라제가 더 이상 그의 기질에 적절하게 부착할 수 없고 페룰레이트 가교를 절단할 수 없을 정도로 리그닌 폴리머가 매우 근접해 있는 경우 페레이트 에스테르 결합은 가수분해되지 않을 수 있다(Jung and Allen, 1995).
고리이량체를 생성하는 광화학적 과정을 통해 및/또는 라디칼 매개 이량체화 또는 커플링에 의해 형성된 이합체는 세포벽 소화를 실질적으로 더 억제합니다.
사실, 세포벽의 ferulate dimer는 "강철 메쉬 프레임의 스폿 용접(spot-welding a steel mesh frame)"의 분자 등가물에 비유되었습니다(Iiyama et al.,1994, p.315).
셀룰라아제, 자일라나아제, 프로테아제 또는 에스테라아제를 포함하여 상업적으로 이용 가능한 EFE에서 일반적으로 분석되는 활성 중 어느 것도 이러한 이철화 라디칼 커플링 결합을 가수분해할 수 없습니다.
또한 β-ether를 제외하고 ferulate 정량화에 사용되는 일반적인 용매에 의해 라디칼 결합 반응에서 발생하는 연결을 해제할 수 없기 때문에 ferulate 이합체의 농도는 수십 년 동안 건초에서 과소 평가되었습니다(Ralph et al.,1995).
리그닌은 세포벽 다당류를 분해하는 미생물 효소에 대한 물리적 장벽으로 작용하는 것으로 보입니다(Jung and Deetz, 1993; Hatfield et al.,2007).
이 효과는 리그닌 자체의 소화불량과 페놀산과의 가교결합으로 인한 소화에 대한 화학적 임피던스에 추가됩니다.
반추위 미생물은 리그닌이 혐기성 반추위 환경에서 분해될 수 없기 때문에 세포벽 다당류 소화에 대한 이러한 장벽을 극복할 수 없습니다(Hatfield et al.,2007).
세포벽 가수분해를 방해하는 리그닌과 디퍼레이트의 중요성은 브라운 미드립 및 저철 "sfe" 옥수수 돌연변이와 같은 이러한 분획의 농도가 낮은 옥수수 돌연변이가 더 소화가 잘 되고 기존의 대조군 대신 먹이를 주면 젖소의 수유로 인해 우유 생산이 증가한다는 사실이 반영됩니다. (Kung et al., 2008; Jung et al.,2011).
Ⅳ. 이상적인 섬유 분해 효소 제품
동물의 성능 향상을 위한 이상적인 EFE는 다음과 같은 특성을 가져야 합니다.
1) NDFD 개선을 위한 강력한 섬유 분해 활동의 적절한 보완물을 포함합니다.
2) 적절한 양의 보조 인자, 보조 효소 및 활성제(필요한 경우)를 함유하여 섬유 분해 활동을 최적화하고 이러한 효소에 대한 억제제가 부족합니다.
3) 반추위 미생물에 의한 분해 또는 식물 또는 반추위 프로테아제에 의한 가수분해에 대한 저항성
4) 효소 배치에 따라 눈에 띄게 달라지지 않는 강력한 조성을 가지고,
5) 자연적으로 또는 유전적 변형을 통해 다량의 효소를 생산하는 쉽게 배양 가능한 균류 또는 박테리아에서 유래한 것,
6) 가수분해 효과를 발휘하는 일반적인 조건에서 최적의 꾸준한 활성을 나타냅니다.
7) 액체 형태이거나 물에 신속하고 완전하게 용해되는 것,
8) 사료 제조 중에 첨가되는 경우 내열성일 것, 9) 장기간 적절하게 저장될 때 가수분해 활성을 유지하고,
10) 일반적으로 안전한 것으로 간주됩니다.
Ⅴ. 동물의 성능을 향상시키기 위해 섬유질 효소를 사용하는 전략적 접근법
동물 사료에 EFE를 추가한 것에 대한 발표된 반응의 가변성의 대부분은 EFE를 증명하기 위한 부적절한 시험관 내 스크리닝 없이 동물에서 직접 효소를 테스트했기 때문입니다.
NDFD 증가에 대한 효능을 확인하고 최적의 선량률을 결정하기 위한 사전 체외 테스트 없이 EFE를 생체 내 테스트하지 않는 것이 좋습니다.
다음과 같은 효소 스크리닝 전략이 권장됩니다.
◆ Enzyme Screening
후보 EFE는 비용이 비슷한 경우 동일한 단백질 또는 주요 활동 기준으로 비교되어야 합니다.
그렇지 않으면 제조업체가 권장하거나 이전에 유효했던 비율로 비교해야 합니다.
시험관 내 24시간 또는 30시간 NDFD는 가장 유망한 EFE 후보를 선택하는 기준으로 사용해야 합니다.
효소가 반추 동물의 식단에 적용될 때 발생하는 효소-기질 상호 작용을 시뮬레이션하기 위해 기질은 시험관 내 NDFD 분석 전에 최대 24시간 동안 EFE와 사전 배양되어야 합니다.
각 EFE는 다른 연구와의 비교를 용이하게 하기 위해 고전적인 효소 활성 및 단백질 정량화 분석으로 특성화되어야 하지만 그 결과는 건초 품질 또는 동물 성능 개선을 위한 후보를 선택하는 데 사용되어서는 안 됩니다.
EFE 활동 분석에 사용되는 순수한 기질은 연구 중인 건초와 가능한 한 유사해야 합니다.
효소 제품 및 상업용 EFE 라벨에는 주요 활동에 대한 적절한 설명을 보장하기 위해 최소한 다음 각 활동이 표시되어야 합니다.
엔도-1,4-β-글루카나아제(EC 3.2.1.4), 엑소-β-1,4-글루카나아제(EC 3.2.1.91), β-글루코시다아제(EC 3.2.1.21), 자일라나아제(EC 3.2.1.8), 및 β-1,4-자일로시다제(EC 3.2.1.37). 가능하면 acetyl-xylan esterase(EC 3.1.1.72), ferulic acid esterase(EC 3.1.1.73) 및 protease 활성도 포함되어야 합니다.
각 효소의 GHe 및 EC 번호도 명시해야 합니다.
각 활동 분석은 환경을 시뮬레이션하는 조건에서 수행해야 합니다.
여기서 효소는 예를 들어 전형적인 미국 및 캐나다 TMR 또는 pH 4를 먹인 젖소의 경우 pH 6 및 온도 39°C에서 작용할 것으로 예상되며 엔실링 동안 작용할 것으로 예상되는 효소의 일반적인 저장 온도입니다.
◆ Enzyme Dose Optimization
특히 EFE의 높은 비용으로 인해 효소를 효율적으로 사용하려면 효소 용량 최적화가 필요합니다.
불충분하고 과도한 효소 투여량은 마초 소화 및 동물 성능을 저하시킬 수 있습니다.
관련 단계는 다음과 같습니다.
1) 이전에 유효하거나 제조업체가 권장하는 용량을 기준선(1x)으로 사용하고 NDFD에 대한 다양한 용량(0, 0.5x, 1x, 2x 및 3x)의 효과를 조사합니다.
2) 다항식 대비를 사용하여 선량률 효과를 결정하고 평균 분리 테스트를 사용하여 추세가 비선형인 경우 최상의 것을 선택합니다.
3) 더 낮은 용량보다 더 큰(P < 0.05) 그러나 더 큰 용량보다 더 적은(P < 0.05) 반응을 제공하지 않는 최저 용량을 선택하고, 4) 선택한 첨가량이 경제적으로 타당한지 확인합니다.
◆ Enzyme Dose Optimization
필요한 실험 단위의 최소 수를 확인하기 위해 통계적 전력 분석을 통해 소의 EFE 검사를 선행합니다.
종종 처리당 15~20두의 젖소가 필요합니다(Arriola et al., 2011b; Holtshausen et al., 2011).
공변량 기간과 적절한 차단(DIM, 패리티, 우유 생산 등)을 사용하여 실험 단위 간의 가변성을 최소화합니다.
젖소는 EFE 매개 에너지 공급 증가에 더 잘 반응하기 때문에 연구 시작 시 수유 초기(21 ± 5 DIM)에 소를 사용하십시오(Schingoethe et al., 1999).
시험관 내에서 결정된 NDFD를 개선하기 위한 최적 용량으로 EFE를 TMR에 적용합니다.
10일 공변량 기간 후 최소 60일 동안 지속되는 연속 설계를 사용합니다(Arriola et al., 2011b; Romero, 2013).
Ⅵ. 전략적 접근 방식의 예시
Eun과 Beauchemin(2007)은 옥수수 사일리지와 알팔파 건초의 시험관 내 NDFD에 대한 다양한 적용 비율로 단독 적용 또는 조합하여 적용된 다양한 EFE의 효과를 조사했습니다.
그들은 2 EFE(Cellulase PLUS 및 Xylanase PLUS; Dyadic International, Jupiter FL)의 75:25 혼합물(이 연구에서는 EFE 3A)이 가장 큰 반응을 보였다고 보고했습니다.
우리는 이 연구가 옥수수 사일리지-알팔파 건초 기반 TMR을 먹인 젖소의 성능을 개선하기 위한 최적의 EFE 조합과 용량을 적절하게 식별했다고 가정했습니다.
따라서 후자의 시험에서 권장 용량 3.4 μL/g의 EFE 3A의 다른 배치를 60일 동안 건초 대 농축 비율이 67:33 및 52:48인 2개의 옥수수 사일리지-알팔파 기반 TMR을 젖소(21 ± 4 DIM) 연구에 적용했습니다.
EFE는 NDFD를 1~2% 증가시켰고, 사료 효율을 약 11% 증가시켰으며, 우유 생산량을 2kg/d까지 미미하게 증가시켰습니다(Arriola et al., 2011b).
그러나 동일한 EFE를 사전 체외 스크리닝 및 용량 최적화 없이 버뮤다그래스 사일리지 기반 TMR에 적용했을 때 젖분비 성능은 영향을 받지 않았습니다(Queiroz et al., 2010; Bernard et al., 2010).
결과적으로 버뮤다그래스 기반 TMR의 NDFD를 확실하게 증가시킬 강력한 EFE를 확인하기 위해 일련의 실험을 수행했습니다.
실험 1은, 5개 회사의 18개 EFE가 Tifton 85 버뮤다그래스 우박의 4주 재성장의 24시간 NDFD에 미치는 영향에 대해 평가되었습니다(Romero et al., 2011b).
현탁액을 25℃에서 24시간 동안 인큐베이션한 후 완충된 반추위액(39℃)을 첨가하고 24시간 동안 3회 더 인큐베이션하였다.
전체 실행에서 12개의 최고 성능 EFE 결과가 Table 4에 나와 있습니다.

대조군과 비교하여 8 EFE는 더 큰 NDFD(35.6 대 37.1~40.4%)를 제공했으며 범위는 4.2~13.5% 증가했습니다.
효소 3A, 2A, 11C, 13D 및 15D는 NDFD 증가의 크기와 일관성을 기반으로 추가 테스트를 위한 가장 유망한 후보였습니다.
실험 2은, 가장 유망한 5가지 효소의 투여량 증가 효과를 테스트했습니다.
적용률을 높이면 모든 효소에 의해 NDFD가 비선형적으로 증가했습니다(Table 5).

섭취 전 가수분해 측정, 시험관 내 DMD 및 반추위 발효 매개변수에 대한 적용률 증가 효과도 작용 방식을 밝히기 위해 조사되었지만 이상적인 적용률의 선택은 NDFD를 기반으로 했습니다.
NDFD(및 대부분의 경우 DMD) 개선을 위한 특정 효소의 최적 용량은 효소 3A, 2A, 11C, 13D 및 15D에 대해 각각 2x, 2x, 1x, 0.5x 및 0.5x였습니다.
1x에서 11C를 적용하면 NDFD가 전반적으로 가장 크게 개선되었지만(대조군에 비해 +16.2%) 젖소 연구에는 사용할 수 없었기 때문에 젖소 연구에서는 차선책인 EFE(2A)를 선택했습니다.
실험 3은 이전 실험에서 정의된 최적의 적용률에서 가장 유망한 5가지 효소에 보조 인자를 추가한 효과를 조사했습니다. 결과는 이전에 이 백서에 요약되어 있습니다(Tables 2 and 3).
실험 4는 이전 실험(2A)에서 확인된 가장 유망한 EFE를 이전 젖소 연구(Arriola et al., 2011a)에서 사료 효율을 개선한 다른 배치(EFE 3A)와 비교했습니다.
두 EFE 모두 0, 0.5, 1, 4 및 8 μL/g DM에서 버뮤다그래스 사일리지, 알팔파 건초 및 옥수수 사일리지에 적용되어 24시간 시험관 내 NDFD를 최적화할 첨가량을 결정했습니다.
두 EFE 모두 용량 의존적 방식으로 각 건초의 NDFD를 증가시켰지만 최적 적용률은 건초에 따라 달랐습니다(Figure 4).
2A EFE는 3A(3.8~9.0%)보다 더 큰 NDFD 증가(6.7~9.2%)를 가져왔고 NDFD 증가는 알팔파 건초와 버뮤다그래스 사일리지의 유사한 증가(4~7%)보다 옥수수 사일리지(9~9.2%)에서 더 컸습니다.
옥수수 사일리지는 우리가 젖소에게 먹일 TMR에서 대부분의 건초를 차지하기 때문에 유제품 실험을 위해 옥수수 사일리지 소화를 최적화하는 첨가량을 적용했습니다.
실험 5는 수유 초기(21 ± 5 DIM)에 66마리의 젖소에게 먹인 옥수수 사일리지, 알팔파 및 버뮤다그래스 기반 TMR에 각각 3.4 및 1 μL/g DM으로 적용된 EFE 3A 및 2A의 효과를 조사하는 것과 관련이 있습니다.
이전 시험에서 2A의 최적 첨가량은 4μL/g이었지만 사용하기에 너무 비싸다고 생각되었습니다.
따라서 다음으로 가장 좋은 용량(1 μL/g)을 사용했습니다.
EFE 3A에 사용된 용량은 Exp 4에서 발견된 최적 용량(4 μL/g)이었으며 이전 연구(Arriola et al., 2011a)에서 사용된 용량(3.4 μL/g)과 유사했습니다.
두 EFE를 모두 적용하면 지방 보정 우유 생산량이 증가하는 경향이 있었지만 2A만이 DMI를 증가시켰습니다.
우유 생산은 10주 시험의 3주, 6주 및 7주 동안 및 6주, 8주 및 9주 동안 각각 2A 및 3A 증가했습니다(Table 6).

이 결과는 권장되는 효소 테스트에 대한 전략적 접근 방식을 검증하고 제공되는 체외 스크리닝 및 용량 최적화 연구에서 최상의 효소를 선택하기 위한 기준으로 NDFD를 사용하고 젖소의 성능을 개선하기 위한 이상적인 EFE 후보 및 최적 용량을 안정적으로 예측할 수 있음을 나타냅니다.
실험 6은 일부 EFE가 다른 것보다 나은 이유를 이해하고자 했습니다.
EFE 2A와 9C를 비교하기 위해 프로테오믹스 연구가 수행되었으며, 후자는 Exp1에서 스크리닝된 18개의 EFE 중 가장 덜 효과적이었습니다(Table 4).
우리는 proteomic 정보의 기능적 기초를 이해하기 위해 생물 정보학과 결합된 iTRAQ(relative and absolute quantification) 기반 정량적 proteomics에 isobaric 태그를 사용했습니다.
2A EFE는 9C와 비교하여 CBM이 있는 엔도글루카나아제 IV가 7.69배, 엔도글루카나아제 III가 10배, 팽윤이 3배 더 많았습니다(Table 7).

또한 2A는 9C에 비해 CBM 1과 함께 17배 더 많은 아세틸자일란 에스테라제, 33배 더 많은 자일라나제, 25배 더 많은 β-자일로시다제를 가지고 있어 훨씬 더 완전하고 강력한 셀룰로오스 및 헤미셀룰로오스 분해 효소 배열을 가지고 있음을 나타냅니다.
9C가 2A에 비해 유일한 장점은 펙틴과 자일로글루칸을 각각 분해하는 람노갈락투로난 아세틸에스테라아제가 28배, β-알락토시다아제가 20배 더 많다는 점이었습니다.
분명히, 이러한 활동은 세포벽의 분해에 결정적이지 않았는데, 부분적으로는 펙틴이 반추위에서 쉽게 소화될 수 있고 대부분의 콩과 식물이 아닌 건초에서와 같이 버뮤다그래스에서 낮은 농도로 발생하기 때문입니다.
Ⅶ. 요약 및 결론
이 논문은 젖소의 능력에 대한 EFE의 식이 첨가 효과에 대한 메타 분석 결과를 요약한 것입니다.
또한 식이 효소 첨가에 대한 공개된 성능 반응이 모호한 이유를 설명하고, 효소 효능을 개선하기 위한 전략적 접근 방식을 제안하고, 후자가 젖소의 능력 개선한 EFE 용량을 선별하고 최적화하는 데 어떻게 사용되었는지 설명했습니다.
마지막으로, 우리는 이상적인 EFE에 대한 기준을 권장하고 효과적인 EFE와 비효과적인 EFE 간의 차이점을 설명하기 위해 proteomic 접근법의 사용에 대해 보고했습니다.
복잡성으로 인해 셀룰로오스와 헤미셀룰로오스를 효과적으로 분해하려면 여러 시너지 섬유 분해 효소가 필요합니다.
식물 세포벽의 리그닌, 페놀산 및 섬유 분획 사이의 교차 결합은 마초 섬유 분해를 더욱 복잡하게 만들고 감소시킵니다.
T. reesei에서 EFE를 소싱하는 이점에도 불구하고, 이 균류와 분비물에 있는 많은 섬유분해 효소는 반추위 조건에서 최적의 활성을 나타내지 않습니다.
따라서 대안이 필요합니다.
우리는 섬유 분해 및 동물의 성능을 향상시키는 역할을 강화하는 방식으로 EFE 활동을 조절하는 무수한 요인을 활용하는 방법에 대해 거의 이해하지 못하고 있습니다.
외인성 섬유분해 효소는 선택 기준으로 시험관 내 NDFD를 사용하여 사전 시험관 내 스크리닝 및 용량 최적화 없이 동물에서 시험해서는 안 됩니다.
향후 연구는 반추위 조건에서 NDFD를 증가시키는 데 강력하고 반복적으로 효과적인 새로운 EFE를 찾거나 기존 후보를 엔지니어링해야 합니다.
또한, 연구는 자생 반추위 미생물과 호기성 섬유분해 박테리아 및 진균에서 글리코실 가수분해효소의 부착 및 분비를 결정하는 요인을 밝히기 위해 전통적 및 분자적 도구를 사용해야 합니다.
또한 EFE를 사용한 식이 요법이 젖소의 성능에 미치는 유익한 효과를 극대화하는 방식으로 섬유 분해 효소 촉매 작용을 조절하는 요인을 활용하기 위한 전략을 고안하기 위한 연구가 필요합니다.
'Animal Bioscience Information' 카테고리의 다른 글
| CVB-Feed-Table-2021 (0) | 2023.02.24 |
|---|---|
| Phytase in Swine Diets - KSU Phytase Calculator (0) | 2023.02.06 |
| Functional Amino Acids in the Development of the Pig Placenta (0) | 2021.07.22 |
| Effects of recovery from short-term heat stress exposure in growing pigs (0) | 2021.07.09 |
| Effect of enzyme type and cereal source (2) | 2021.07.05 |




